1、填空题 化学推断常用到离子共存知识和有关新知识的预测 :现有A、B两瓶混合溶液,两瓶溶液中所含8种离子是:Na+、K+、Al3+、H+、NO3-、Cl-、OH-、CO32-,已知每组溶液中均含两种阳离子和两种阴离子。
(1)A组:H+、?。
(2)将两组溶液混合,其中两种离子与水共同反应,同时得到白色沉淀和无色气体,该反应的离子方程式是?。
参考答案:(1) Al3+、NO3-、Cl-?(2) 2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
本题解析:(1)如果溶液显酸性,则OH-、CO32-不能大量共存,所以A组中一定含有NO3-、Cl-。而铝离子与OH-、CO32-不能大量共存,所以A组中还含有Al3+。
(2)两种离子与水共同反应,同时得到白色沉淀和无色气体的是Al3+与CO32-,所以反应的离子方程式是2 Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑.
点评:该题是中等难度的试题,试题注重基础,难易适中,侧重能力的培养和解题方法的训练与指导。有利于培养硝酸的逻辑推理能力和创新思维能力,提高学生分析问题、以及灵活运用基础知识解决实际问题的能力。
本题难度:一般
2、选择题 能在溶液中大量共存的一组离子或分子是
[? ]
A.NH4+ H+ NO3- HCO3-
B.K+ Al3+ SO42- NH3·H2O
C.Na+ K+? SO32-? Cl2
D.Na+ CH3COO- CO32- OH-
参考答案:D
本题解析:
本题难度:一般
3、选择题 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32?、SO42?、NO3?中的几种。
①若加入锌粒,产生无色无味无毒的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如下图所示。则下列说法正确的是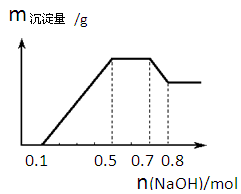
A.溶液中的阳离子只有H+、Mg2+、Al3+
B.溶液中n(NH4+)=0.2mol
C.溶液中一定不含CO32?,可能含有SO42?和NO3?
D.三种离子的物质的量之比:n(H+)∶n(Al3+)∶n(Mg2+) = 1∶1∶1
参考答案:B
本题解析:若加入锌粒,产生无色无味无毒的气体,说明气体是氢气,因此溶液显酸性,则CO32-和NO3-不能大量共存;加入NaOH溶液,产生白色沉淀,说明不存在铁离子;根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有Mg2+、Al3+;又因为当沉淀达到最大值时,继续进入氢氧化钠,沉淀不变,这说明溶液中还存在NH4+,其n(NH4+)=0.7mol-0.5mol=0.2mol;由于溶液中还必须存在阴离子,所以一定还有SO42?。根据题型可知,氢离子的物质的量时0.1mol、铝离子的物质的量是0.1mol,但镁离子是(0.5mol-0.1mol-0.3mol)÷2=0.05mol,所以只要选项B正确,答案选B。
点评:该题是高考中的常见题型,难度较大,对学生的综合能力提出了更高的要求。本题有利于培养学生严谨的逻辑思维能力和发散思维能力,特别是结合图像分析的灵活应变能力、该题有利于调动学生的学习积极性,有利于提高学生的学习效率。
本题难度:简单
4、选择题 在KHSO4的水溶液及熔化两种状态下都能存在的离子是(?)
A.K+
B.H+
C.HSO4-
D.SO42-
参考答案:A
本题解析:物质熔化可破坏离子键,但不能破坏共价键,在水溶液中,可破坏离子键也可破坏强极性共价键。KHSO4熔化电离:KHSO4 K++ HSO4-?,水溶液电离:KHSO4
K++ HSO4-?,水溶液电离:KHSO4 K++H++ SO42-。
K++H++ SO42-。
本题难度:一般
5、简答题 下列各组离子在溶液中能大量共存的是( )
A.Na+、Al3+、Cl-、SO42-
B.Cu2+、Cl-、NO3-、OH-
C.Ca2+、Na+、CO32-、NO3-
D.H+、SO42-、NO3-、F-
参考答案:A.离子之间不发生任何反应,能大量共存,故A正确;
B.Cu2+与OH-反应生成Cu(OH)2沉淀而不能大量共存,故B错误;
C.Ca2+与CO32-反应生成CaCO3沉淀而不能大量共存,故C错误;
D.H+与F-生成弱电解质HF而不能大量共存,故D错误.
故选A.
本题解析:
本题难度:一般