1、填空题 化工生产中常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)“三酸”与“两碱”之间均可反应,酸过量时, 若用化学方程式表示有六个,若用离子方程式表示却只有两个,一个是H++OH-=H2O,请写出另一个离子方程式:?。
(2) 实验室制备H2、CO2、NH3、SO2时,用盐酸和稀硫酸可制备的相同气体是_______。
(3)烧碱、纯碱溶液均可吸收CO2,当含0.1 mol NaOH的溶液吸收一定量CO2后,将溶液低温小心蒸干得到固体的组成可能有四种情况,分别是(填化学式):
①?;②Na2CO3;③Na2CO3和NaHCO3;④NaHCO3。
(4)将(3)得到的固体重新溶解于水,向其中加入盐酸,调节溶液的pH恰好等于7,再将溶液蒸干,最终得到固体的质量为?g。
(5)利用侯德榜制碱法可制两碱的一种,请写出制取小苏打时在溶液中发生反应的总化学方程式?。
参考答案:(1)CO32-+2H+=H2O+CO2↑?(2分)
(2)H2(2分)
(3)Na2CO3和NaOH?(2分)
(4)5.85g (2分)
(5)H2O+CO2+NaCl+NH3=NaHCO3↓+NH4Cl?(2分)
本题解析:(1)碳酸钠因其水溶液显现碱性而俗称纯碱。在物质的分类上属于盐。酸都电离产生氢离子H+,氢氧化钠电离产生OH-, Na2CO3电离产生CO32-,故发生上述两个离子反应,除了H++OH-=H2O,肯定有纯碱Na2CO3,写离子方程式应该是CO32-+2H+=H2O+CO2↑。
(2) 实验室制备H2用盐酸和稀硫酸可制备、实验室制备CO2只能用盐酸和碳酸钙制备,不能用稀硫酸、NH3实验室制备用氯化铵和氢氧化钙固体、SO2实验室制备用Na2SO3和浓硫酸,综上所述,相同气体是氢气。
(3)在NaOH溶液中通人一定量的CO2后,溶液中的溶质的组成分析:用数轴表示为
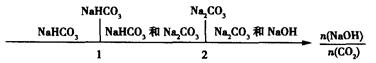
当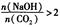 时,溶质的组成为NaOH和Na2CO3;当
时,溶质的组成为NaOH和Na2CO3;当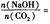 2时,溶质的组成为Na2CO3;当
2时,溶质的组成为Na2CO3;当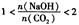 时,溶质的组成为Na2CO3和NaHCO3;当
时,溶质的组成为Na2CO3和NaHCO3;当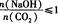 时,溶质的组成为NaHCO3。
时,溶质的组成为NaHCO3。
(4)将(3)得到的固体重新溶解于水,向其中加入盐酸,调节溶液的pH恰好等于7,说明全部转变成了氯化钠,氯化钠和氢氧化钠的物质的量相等,0.1 mol 氯化钠的质量为5.85gg。
(5)侯氏制碱法原理,是依据离子反应发生的原理进行的,离子反应会向着离子浓度减小的方向进行。要制纯碱,先制得溶解度较小的NaHCO3。再利用碳酸氢钠不稳定性分解得到纯碱。要制得碳酸氢钠就要有大量钠离子和碳酸氢根离子,所以就在饱和食盐水中通入氨气,形成饱和氨盐水,再向其中通入二氧化碳,在溶液中就有了大量的钠离子,铵根离子,氯离子和碳酸氢根离子,这其中NaHCO3溶解度最小,所以析出,其余产品处理后可作肥料或循环使用。反应方程式为H2O+CO2+NaCl+NH3=NaHCO3↓+NH4Cl。
本题难度:一般
2、选择题 下列气体中,无色无味的是 (? )?
A.SO2?B.NO2?C.Cl2? D.N2
参考答案:D
本题解析:SO2是无色有刺激性气味的气体,NO2是红棕色有刺激性气味的气体,氯气是黄绿色有刺激性气味的气体,氮气是无色无味,答案选D。
点评:该题是基础性试题的考查,难度不大,试题基础性强,该题的关键是学生要熟练记住常见气体的物理性质。
本题难度:简单
3、选择题 下列各组物质中,互为同位素的是( )
A.
Mg和Mg
B.O2和O3
C.NO和NO2
D.H2O和H2O2
参考答案:A
本题解析:
本题难度:简单
4、选择题 下列各组元素性质的递变情况中,错误的是( )
A.Li、Be、B原子的最高正价依次增大
B.P、S、Cl元素的最高价氧化物对应水化物的酸性依次增强
C.B、C、N、O、F的原子半径依次增大
D.Li、Na、K、Rb元素的金属性依次增强
参考答案:A、Li、Be、B原子的最高正价分别为+1、+2、+3,故A正确;
B、元素的非金属性P<S<Cl,则最高价氧化物对应水化物的酸性依次增强,故B正确;
C、B、C、N、O、F均在第二周期,原子序数逐渐增大,则从左向右原子半径在减小,故C错误;
D、Li、Na、K、Rb在同一主族,从上到下金属性在增强,故D正确;
故选C.
本题解析:
本题难度:一般
5、选择题 只用试管和胶头滴管就可以对下列各组中的两种溶液进行鉴别的是 ( )
①AlCl3溶液和NaOH溶液
②Ca(HCO3)2溶液和NaOH溶液
③NaAlO2溶液和盐酸
④Al2(SO4)3溶液和氨水
A.①③
B.①②③
C.②③④
D.③④
参考答案:A
本题解析:只用试管和胶头滴管就可以对两种溶液进行鉴别,这说明两种物质反应的顺序不同时,会产生不同的实验现象,据此才能鉴别。②和④中的反应现象与反应顺序无关系,不正确,由于氢氧化铝是两性氢氧化物,能溶于氢氧化钠和盐酸中,A正确答案选A。
点评:该题是高考中的常见题型,属于中等难度的试题。该题学生需要明确进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可。
本题难度:一般