1、选择题 将足量的BaCO3分别加入:
①30mL水?②10mL0.2mol/LNa2CO3溶液?
③50m L0.01mol/LBaCl2溶液?④100mL0.01mol/LHCl溶液
中溶解至溶液饱和,请确定各溶液中Ba2+的浓度由大到小的顺序为( )
A.①②③④
B.③④①②
C.④①③②
D.②①④③
参考答案:B
本题解析:①30mL水,存在BaCO3的沉淀溶解平衡。
②10mL0.2mol/LNa2CO3溶液 ,同离子效应,BaCO3的沉淀溶解平衡左移,钡离子浓度比①小
③50m L0.01mol/LBaCl2溶液,此时溶液中的钡离子浓度约为0.01mol/L
④100mL0.01mol/LHCl溶液,盐酸和碳酸钡反应生成氯化钡,氯离子浓度为0.01mol/L,钡离子浓度为0.005mol/L。由此可见,Ba2+的浓度由大到小的顺序为③④①②,选B
本题难度:简单
2、简答题 ①CO CO2;②H2 D2 T2;③3517Cl3717Cl;④14C14N;⑤液氨氨水⑥O2 O3⑦CH2=CH2CH3CH2CH3⑧CH3CH2OHCH3OH⑨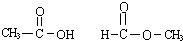 ⑩
⑩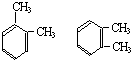
其中属于互为同位素的是______,同素异形体是______,同分异构体是______,同系物是______,同种物质是______.
参考答案:同位素:质子数相同中子数不同的同一元素的原子互称同位素,则③互为同位素;
同素异形体:同种元素组成的不同单质,则⑥属于同素异形体;
同分异构体:分子式相同结构不同的化合物,则⑨属于同分异构体;
同系物:结构相似,在分子组成上相差一个或若干个CH2原子团的化合物,则⑧属于同系物;
分子式相同结构也相同的物质时同种物质:⑩;
故答案为:③;⑥;⑨;⑧;⑩.
本题解析:
本题难度:简单
3、选择题 M元素的1个原子失去2个电子转移到Y元素的2个原子中形成化合物Z,下列说法中正确的是?
[? ]
A.Z的电子式为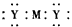
B.Z可表示为M2Y
C.M 一定属于第ⅡA族元素
D.M可形成+2价阳离子
参考答案:D
本题解析:
本题难度:一般
4、选择题 几种短周期元素的原子半径及某些化合价见下表.分析判断下列说法正确的是( )
| 元素代号 | A | B | D | E | G | H | I | J
化合价
-1
-2
+4、-4
-1
+5、-3
+3
+2
+1
原子半径/nm
0.071
0.074
0.077
0.099
0.110
0.143
0.160
0.186
|
A.A的单质能将E单质从HE3的溶液中置换出来
B.A、H、J的离子半径由大到小顺序是A>J>H
C.G元素的单质不存在同素异形体
D.I在DB2中燃烧生成两种化合物
参考答案:根据元素的最高正价=最外层电子数,最高正价+|最低负价|=8,最低负价=最外层电子数-8,同周期元素原子从左到右原子半径逐渐减小,同主族元素原子半径从上到下逐渐增大,可推知:A为F,B为O,D为C、E为Cl,G为P;H为Al,I为Be,J为Na,
A、F2极易和水反应置换出氧气,则A的单质不能将E单质从HE3的溶液中置换出来,故A错误;
B、A、J、H分别为F、Na、Al,它们的离子核外电子层数相等,离子半径大小顺序为:F->Na+>Al3+,故B正确;
C、红磷和白磷互为同素异形体,故C错误;
D、金属铍和镁性质相识,在二氧化碳中的燃烧生成氧化铍和碳单质,故D错误.
故选B.
本题解析:
本题难度:简单
5、选择题 下列描述违背化学原理的是
A.NaHCO3溶液与NaAlO2溶液混合产生白色沉淀,说明结合H+的能力:AlO2->CO32-
B.将SO2通入酸性高锰钾溶液中,溶液褪色,不能说明SO2具有漂白性
C.高温时碳能置换出二氧化硅中的硅,说明还原性碳比硅强
D.亚硫酸是良好的还原剂,浓H2SO4是良好的氧化剂,但两者混合,却不发生氧化还原反应
参考答案:C
本题解析:NaHCO3溶液与NaAlO2溶液,反应中碳酸氢钠提供氢离子与偏铝酸根反应生成生成Al(OH)3,说明结合H+的能力:AlO2->CO32-,A正确;将SO2通入酸性高锰钾溶液中,溶液褪色,这是SO2具有还原性,B正确;还原性比较条件可以认为是:外界不加能量,如果外界加了能量,不能说明还原性大小,可以这么认为在高温下,碳和二氧化硅生成的一氧化碳是气体,根据化学平衡移动的原理,平衡是向正反应方向移动,即生成硅和一氧化碳,C错误;同种元素相邻价态间不发生氧化还原反应,D正确。
本题难度:简单