|
高考化学试题《氯及其化合物》考点强化练习(2017年押题版)(十)
2017-11-05 22:20:04
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 为了防止吸进氯气中毒,可以用浸有某种物质水溶液的毛巾捂住鼻子,该物质最适宜采用
A.氢氧化钠
B.纯碱
C.NH3
D.醋酸
参考答案:B
本题解析:略
本题难度:简单
2、实验题 某学生利用以下装置探究氯气与氨气之间的反应。其中C为纯净干燥的氯气与氨气反应的装置。

请回答下列问题:
(1)装置A中的烧瓶内固体不能选用?
A.生石灰
B.碱石灰
C.五氧化二磷
D.烧碱
| (2)装置A中发生反应的化学方程式为?
(3)B装置的作用?;E装置的作用?
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。写出反应的化学方程式:?
(5)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,需要处理,?
写出离子方程式?
实验室制备氨气,下列方法中适宜选用的是?。
①固态氯化铵加热分解?②浓氨水中加入固体氢氧化钠
③加热浓氨水?④固态氯化铵与氢氧化钙混合加热
参考答案:(1)C
(2)NH3·H2O =NH3↑ +H2O
(3)干燥气体,吸收HCl
(4)8NH3 +3Cl2 =N2 +6 NH4Cl
(5)Cl2 +2OH-= Cl- +ClO- +H2O
②③④
本题解析:略
本题难度:简单
3、选择题 下列有关物质的性质或应用不正确的是?
A.一定条件下,镁和铁的单质与水反应都有氢气生成
B.浓硫酸能干燥SO2、NO2等气体,说明浓硫酸具有吸水性
C.SO2具有漂白性,通入紫色石蕊溶液中能使溶液先变红后褪色
D.可用FeCl3溶液除去试管内壁上的难以刷去的铜迹
参考答案:C
本题解析:C项:将SO2气体通入紫色石蕊试液中,溶液变为红色,可说明二氧化硫为酸性氧化物,不能说明其漂白性,故错。故选C。
点评:本题考查的无机物的性质及化学反应,考查学生对基础知识的掌握程度,题目难度不大。
本题难度:简单
4、填空题 漂白粉在潮湿的空气中易变质失效,请回答:存放环境中①有水蒸气无二氧化碳②有二氧化碳无水蒸气,哪种情况下漂白粉更易变质?为什么?
参考答案:①有水蒸气无二氧化碳易变质。因为在②所说的环境中,即使有二氧化碳,由于没有水份参加,二氧化碳与漂白粉仍然不会发生反应;但在有水蒸气存在的情况下,即使没有二氧化碳,也会由于漂白粉中Ca(ClO)2的水解而使漂白粉变质。
本题解析:漂白粉变质的原因是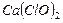 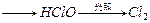 ↑。 ↑。
本题难度:简单
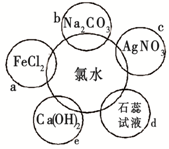
5、简答题 氯水具有多种性质,根据新制氯水分别与如图五种物质发生的反应填空(氯水足量):
(1)a、b、c中反应的离子方程式为:______e中的化学反应方程式为______.上述反应中发生了氧化还原反应的是:______(填“a”、“b”、“c”或“e”).
(2)能证明氯水具有漂白性的现象是______.
(3)久置的氯水变为______,用化学反应方程式表示为______.
(4)实验室保存饱和氯水的方法是______.
参考答案:氯水中存在反应Cl2+H2O=H++Cl-+HClO,溶液中存在Cl2、HClO、H+、Cl-等粒子,
(1)氯气具有氧化性,可与氯化亚铁发生2Fe2++Cl2═2Fe3++2Cl-,因溶液呈酸性,可与碳酸钠发生2H++CO32-═H2O+CO2↑,溶液中含有氯离子,加入硝酸银可生成沉淀,反应的离子方程式为Ag++Cl-═AgCl↓,氯气和与氢氧化钙反应生成氯化钙和次氯酸钙,为制备漂白粉的主要反应,方程式为2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O,涉及氧化还原反应的为ae,
故答案为:2Fe2++Cl2═2Fe3++2Cl-、2H++CO32-═H2O+CO2↑、Ag++Cl-═AgCl↓;2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O;ae;
(2)氯气和水反应生成盐酸和次氯酸,其中盐酸可使石蕊变红,但生成的次氯酸具有漂白性,最终可使石蕊褪色,故答案为:氯水与石蕊试液反应,先变红后褪色;
(3)新制氯水中含有次氯酸,由于次氯酸不稳定,见光分解生成盐酸和氧气,发生2HClO光.2HCl+O2↑,最终变为稀盐酸,
故答案为:稀盐酸;2HClO光.2HCl+O2↑;
(4)因氯水中的次氯酸见光易分解,则保存时应避光、密闭保存,故答案为:在阴凉处置于棕色试剂瓶中密封保存.
本题解析:
本题难度:一般
|