1、填空题 铜跟氯气在点燃条件下可发生反应:Cu+Cl2=CuCl2.在该反应中,氯元素的化合价______(填“升高”或“降低”),被______(填“氧化”或“还原”,下同);Cl2作______剂,具有______性.若反应中消耗了1molCu,则生成______molCuCl2.
参考答案:该反应Cu+Cl2=CuCl2中,氯元素的化合价由0价变为-1价,所以氯元素的化合价降低,在反应中被还原,得电子化合价降低的反应物是氧化剂,氧化剂具有氧化性,根据原子守恒知,若反应中消耗了1molCu,则生成 1molCuCl2,
故答案为:降低,还原,氧化,氧化,1.
本题解析:
本题难度:简单
2、简答题 某同学应用如下所示装置研究物质的性质.其中气体A的主要成分是氯气,还含有少量空气和水蒸气.请回答下列问题: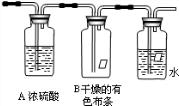
(1)该项实验的主要目的是研究干燥的氯气有没有______性.
(2)浓硫酸的作用是______.
(3)实验过程中观察到B瓶中干燥的有色布条(“褪”或“不褪”)______色.
(4)在该实验中,装置还存缺陷,你认为还需加______装置才能使装置符合要求.
参考答案:(1)该实验通过观察干燥氯气与湿氯气分别对有色布条的漂白作用,来研究干燥的氯气有没有漂白性,故答案为:漂白;
(2)浓H2SO4具有吸水性,可吸收水蒸气,在本实验中的作用是干燥氯气,故答案为:干燥氯气;
(3)与研究目的直接相关的实验现象是:
A瓶中湿氯气在浓硫酸瓶中鼓泡后被干燥;
B瓶中干燥的布条不褪色,说明干燥氯气没有漂白性;
C瓶中氯气与水生成氯水、有色布条褪色,说明湿氯气对有色布条的漂白作用明显;故答案为:不褪;
(4)氯气有毒,排放到空气中会污染空气,应进行尾气吸收,在装置后加上尾气吸收装置(类似C瓶),吸收液为烧碱溶液,故答案为:尾气吸收.
本题解析:
本题难度:一般
3、选择题 0.1mol某元素的单质直接与足量氯气反应,质量增加7.1g,这种元素可能是
(? )
A.Na
B.Al
C.Fe
D.Cu
参考答案:D
本题解析:由题意可知1mol 的金属可消耗1mol(相当于71g)的氯气,由化学方程式可知铜符合条件,故选D
本题难度:简单
4、选择题 用玻棒蘸取新制氯水滴在pH试纸中部,观察到的现象是( )
A.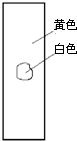
B.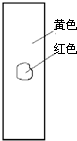
C.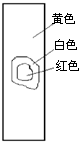
D.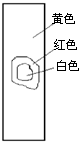
参考答案:由氯水的成分可知,含有氯气和次氯酸以及盐酸等成分,具有酸性,其中次氯酸的漂白是化学漂白,中间的一部分被次氯酸漂白形成白色,而旁边的一部分没有和次氯酸发生反应,所以仍然有指示剂的效用,氯水的酸性使得pH试纸显红色,只有D符合,
故选D.
本题解析:
本题难度:一般
5、选择题 2008北京奥运会与2008北京残奥会奖牌采用“金镶玉”奖牌。经过国家有关部门认定,金镶玉奖牌中用的玉为透闪石玉(昆仑玉)。闪石是指具有宝石价值的硅酸盐矿物。大多数的玉其化学成分都属于硅酸盐,为了研究方便,将它们的化学式用盐或氧化物的形式表示,据此,下列说法不正确的是
A.钙沸石Ca(Al2Si3O10)·3H2O可表示为:CaO·Al2O3·3SiO2·3H2O
B.正长石KAlSi3O8可表示为:K2O·Al2O3·6SiO2
C.透闪石玉Ca2Mg5Si8O22(OH)2可表示为:2CaSiO3·5MgSiO3·H2O
D.高岭石Al2(Si2O5)(OH)4可表示为:Al2O3·2SiO2·2H2O
参考答案:C
本题解析:C项2CaSiO3·5MgSiO3·H2O中Ca与Si的原子个数比为2∶7,而Ca2Mg5Si8O22(OH)2中Ca与Si的原子个数比为2∶8。故选C。
本题难度:简单