1、选择题 已知氨气分子和甲烷分子的空间构型分别为三角锥形和正四面体,造成这一差异的主要原因是?
A.两种分子中心原子的杂化类型不同
B.两种分子中键的极性和分子的极性不同
C.NH3分子中存在有一对未成键的孤对电子
D.氨气分子之间和甲烷分子之间的作用力类型不同
参考答案:C
本题解析:
正确答案:C
A.不正确,两种分子中心原子的杂化类型相同,均为sp3杂化
B.不正确,两种分子中键的极性和分子的极性不同,但不是主要原因。
C.正确,NH3分子中存在有一对未成键的孤对电子,使氨分子变成三角锥形。
D.不正确,氨气分子之间和甲烷分子之间的作用力类型不同,导致分子在水中的溶解性和熔点、沸点不同,对分子形状没有影响。
本题难度:简单
2、填空题 (15分)砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩.
(1)基态砷原子的电子排布式为_______________,砷与溴的第一电离能较大的是______.
(2)AsH3是无色稍有大蒜味气体.AsH3的沸点高于PH3,其主要原因是
________________________________________________.
(3)Na3AsO4可作杀虫剂.AsO43-的空间构型为_____________,与其互为
等电子体的一种分子为______________.
(4)某砷的氧化物俗称“砒霜”,其分子结构如图所示,该化合物的分子式为__________,As原子采取_______杂化.

(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与_______个Ga相连,As与Ga之间存在的化学键有_____________(填字母)。
A.离子键
B.氢键
C.配位键
D.金属键 E.极性键
参考答案:(1)[Ar]3d104s24p3(2分)? Br(或溴)(1分)
(2)AsH3的相对分子质量大于PH3的相对分子质量,故AsH3分子间作用力大于PH3分子间作用力(2分)
(3)正四面体形(2分)? CCl4(或其他合理答案)(1分)
(4)As4O6(2分)? sp3(2分)?(5)4(1分)? C E(2分)
本题解析:(1)根据构造原理可知,基态砷原子的电子排布式为[Ar]3d104s24p3。非金属性越强,第一电离能越大,所以溴的第一电离能大于砷的。
(2).AsH3和PH3形成晶体都是分子晶体,其沸点高低与分子间作用力强弱有关系。由于AsH3的相对分子质量大于PH3的相对分子质量,故AsH3分子间作用力大于PH3分子间作用力,所以AsH3的沸点高于PH3的。
(3)根据AsO43-的结构可知,其空间构型是正四面体。等电子体是指价电子数和原子数分别都相等的物质。AsO43-中价电子数是5+6×4+3=32,所以与其互为等电子体的是四氯化碳。
(4)根据砒霜的分子结构图可知,分子式为As4O6,由于化学键都是单键,所以是sp3杂化。
(5)晶体结构与金刚石相似,所以GaAs晶体中,每个As与4个Ga相连。As与Ga之间存在的化学键是极性键,由于Ga的价电子是3个,所以还存在配位键,答案选CE。
本题难度:一般
3、选择题 已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
A.质子数:c>d
B.离子的还原性:Y2->Z-
C.氢化物的稳定性:H2Y>HZ
D.原子半径:X<W
参考答案:因四种离子的电子层结构相同,所以质子数a、b、c、d的大小关系应为a>b>d>c,且Y、Z在上一周期,Y在Z的左边,Y的非金属性小于Z;W、X在下一周期,X在W的左边,X的金属性大于W.
A、质子数d>c,故A错误;
B、离子的还原性:Y2->Z-,故B正确;
C、氢化物稳定性应为HZ>H2Y,故C错误;
D、原子半径大小关系应为X>W,故D错误;
故选B.
本题解析:
本题难度:简单
4、选择题 根据下列微粒结构示意图的共同特征,可以把三种微粒归为一类。下列微粒中可以归为此类的微粒是
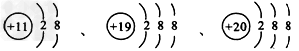
[? ]
A.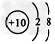
B.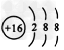
C.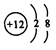
D.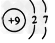
参考答案:C
本题解析:
本题难度:简单
5、简答题 A、B、C、D、E五种短周期主族元素的原子序数依次增大,且知:①其原子半径大小关系是C>D>E>B>A;②A、C同主族,B、D同主族;③B是地壳中含量最多的元素.请填写以下空白:
(1)化合物C2B2的电子式为______.
(2)B、D分别与A形成的结构相似的两种化合物的沸点高低为______>______,原因是______.
(3)已知lgA与E的单质反应时放出92.3kJ热量,写出该反应的热化学方程式______.
(4)B、C、D可以形成一种常见化合物M,M的水溶液呈碱性的原因是______(用离子方程式表示);M与E的单质反应的离子方程式为______.
(5)以上元素能形成的具有漂白性的化合物有______(至少写三种).
参考答案:A、B、C、D、E五种短周期主族元素的原子序数依次增大,B是地壳中含量最多的元素,则B为氧元素;B、D同主族,则D为硫元素;E的原子序数最大,故E为Cl元素;A、C同主族,原子半径大小关系是C>D>E>B>A,A不可能处于ⅦA族,故A为氢元素、C为Na元素,
(1)化合物Na2O2的电子式为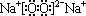 ,
,
故答案为: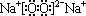 ;
;
(2)O、S与H形成的结构相似的两种化合物分别为H2O、H2S,由于H2O分子之间存在氢键,故沸点H2O>H2S,
故答案为:H2O、H2S;H2O分子之间存在氢键;
(3)lg氢气与氯气反应时放出92.3kJ热量,1mol氢气反应放出的热量为92.3kJ×1mol×2g/mol1g=184.6kJ,该反应的热化学方程式为:H2(g)+Cl2(g)=HCl(g)△H=-184.6kJ/mol,
故答案为:H2(g)+Cl2(g)=HCl(g)△H=-184.6kJ/mol;
(4)O、Na、D形成一种常见化合物M,M的水溶液呈碱性,则M为Na2SO3,Na2SO3溶液中SO32-水解SO32-+H2O?HSO3-+OH-,平衡水的电离平衡,溶液呈碱性;
Na2SO3与氯气反应的离子方程式为:SO32-+Cl2+H2O=SO42-+Cl-+H+,
故答案为:SO32-+H2O?HSO3-+OH-;SO32-+Cl2+H2O=SO42-+Cl-+H+;
(5)以上元素能形成的具有漂白性的化合物有:H2O2、Na2O2、SO2、HClO等,
故答案为:H2O2、Na2O2、SO2、HClO等.
本题解析:
本题难度:一般