1、简答题 钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”。试回答下列问题:
(1)钛有 两种原子,它们互称为____。元素在元素周期表中的位置是第_____周期,第____族;基态原子的电子排布式为_____;按电子排布Ti元素在元素周期表分区中属于_____区元素。
两种原子,它们互称为____。元素在元素周期表中的位置是第_____周期,第____族;基态原子的电子排布式为_____;按电子排布Ti元素在元素周期表分区中属于_____区元素。
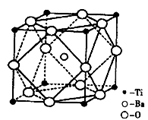
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构如图所示,它的化学式是______,
(3)氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金装饰的替代品。以TiCl4为原料,经过一系列反应,可以制Ti3N4和纳米TiO2
 。
。
①Ti3N4中元素的化合价为_____。TiCl4分子中4个氯原子不在同一平面上,则TiCl4的空间构型为______。
②反应①为置换反应、该反应的化学方程式为______。
③纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如下:

化合物甲的分子中采取 杂化的碳原子个数为_____,化合物乙中采取
杂化的碳原子个数为_____,化合物乙中采取 杂化的原子的第一电离能由大到小的顺序为_____。
杂化的原子的第一电离能由大到小的顺序为_____。
④有一种氮化钛晶体的晶胞如图所示,该氮化钛晶胞中含有______个N原子,晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为______g.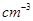 ?(NA为阿伏加德罗常数的数值,只列算式)。
?(NA为阿伏加德罗常数的数值,只列算式)。

参考答案:(1)同位素?四? IVB? 1s22s22p63s23p63d24s2? d;
(2)BaTiO3
(3)①+4?正四面体;② 2Mg+TiCl4 Ti+2MgCl2?③7? N>O>C ;④4?
Ti+2MgCl2?③7? N>O>C ;④4?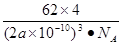
本题解析:(1)钛的这两种原子质子数相同,而中子数不同,使用属于同位素。22元素Ti在元素周期表中的位置是第四周期第ⅣB。基态Ti原子的电子排布式为1s22s22p63s23p63d24s2。按电子排布Ti元素在元素周期表分区中属于d区元素。(2)在每个偏钛酸钡晶体中晶胞中含有Ba:1;Ti:8×1/8="1;" O:12×1/4=3.所以偏钛酸钡的化学式是BaTiO3. (3)①根据在任何化合物中正负化合价的代数和为0的原则。可知:在Ti3N4中元素的化合价为Ti:+4价,N:-3价。由于在TiCl4中四个Cl原子不在一个平面内。则TiCl4的空间构型为 正四面体型。②TiCl4与Mg发生的是为置换反应,该反应的化学方程式为Mg+TiCl4 Ti+2MgCl2。③在化合物
Ti+2MgCl2。③在化合物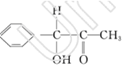 中采用sp2杂化的碳原子有苯环上的6个C原子和羰基
中采用sp2杂化的碳原子有苯环上的6个C原子和羰基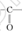 上的C原子,共有7个C原子。化合物乙
上的C原子,共有7个C原子。化合物乙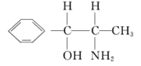 中采取
中采取 杂化的原子有C、N、O三个,当原子核外的电子处于全充满、半充满或全空时是稳定的状态,N原子的2p轨道处于半充满的稳定状态。其余的则原子核外的电子数越多,原子越难失去电子。因此它们的第一电离能由大到小的顺序为N>O>C。④N原子在顶点和面心上,Ti在棱边上和体内。所以每个晶胞中含有的原子个数为:N:8×1/8+6×1/2=4;Ti:12×1/4+1=4.即每个晶胞内含有4个TiN。由晶胞图可知: www.91exAm.org晶胞的边长为2a×10-10cm.
杂化的原子有C、N、O三个,当原子核外的电子处于全充满、半充满或全空时是稳定的状态,N原子的2p轨道处于半充满的稳定状态。其余的则原子核外的电子数越多,原子越难失去电子。因此它们的第一电离能由大到小的顺序为N>O>C。④N原子在顶点和面心上,Ti在棱边上和体内。所以每个晶胞中含有的原子个数为:N:8×1/8+6×1/2=4;Ti:12×1/4+1=4.即每个晶胞内含有4个TiN。由晶胞图可知: www.91exAm.org晶胞的边长为2a×10-10cm.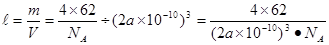
本题难度:一般
2、选择题 下列关于乙酸的叙述正确的是
[? ]
A.乙酸酸性较弱,不能使紫色石蕊变红
B.乙酸分子中既有极性键,又有非极性键
C.乙酸在常温下能与NaOH、Na2CO3、乙醇等发生化学反应
D.等体积等浓度的盐酸和乙酸中加入足量的锌粒,乙酸产生的氢气质量大
参考答案:B
本题解析:
本题难度:一般
3、选择题 雪花,被人们称为“冬之精灵”。科学研究发现,世界上没有两片雪花的形状是完全相同的。不同雪花中,水分子(?)

A.数目都是巨大的
B.数目都是相同的
C.化学性质不相同
D.空间排列方式相同
参考答案:A
本题解析:略
本题难度:一般
4、选择题 某元素气态氢化物化学式为H2R,则其最高价氧化物对应的水化物化学式为( )
A.H2RO3
B.H2RO4
C.HRO3
D.H3RO4
参考答案:元素R的气态氢化物的化学式为H2R,所以R的最低负价为-2价,所以元素R的最高正价为+6价,
A.H2RO3中R元素化合价为+4,故A不符合;
B.H2RO4中R元素化合价为+6,故B符合;
C.HRO3中R元素化合价为+5,故C不符合;
D.H3RO5中R元素化合价为+5,故D不符合,
故选B.
本题解析:
本题难度:一般
5、填空题 物质的结构是决定物质性质的重要因素。请回答下列问题:
(1)基态Ni原子核外电子排布式为____________;第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是_________________。
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分为0.069nm和0.078nm,则熔点NiO_____________FeO(填“<”或“>”);NiO晶胞中Ni2+的配位数为____________。
(3)肼可用作火箭燃料,燃烧时发生的反应是:N2O4+2N2H4=3N2+4H2O,若该反应中有4molN—H键断裂,形成的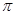 键有________mol。
键有________mol。
参考答案:(8分)(1)1s22s22p63s23p63d84s2(2分);C(碳)(2分) (2)>(1分) 6(1分)(3)3(2分)
本题解析:(1)Ni的原子序数为28,根据构造原理和能量最低原理可写出电子排布式为1s22s22p63s23p63d84s2。第二周期有2个未成对电子的元素是C和O元素,非金属性越强,电负性越大。碳元素的非金属性弱于氧元素,因此电负性较小的是C元素。
(2)Ni2+和Fe2+的离子半径分别为69pm和78pm,离子半径越小,离子键作用力越大,晶体的熔沸点越高,所以熔点NiO>FeO。NaCl中钠离子和氯离子的配位数分别为6,NiO的晶体结构类型与氯化钠的相同,NiO晶胞中Ni和O的配位数分别为6。
(3)单键都是 键,双键都是由1个
键,双键都是由1个 键和1个
键和1个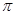 键构成的,而三键是由1个
键构成的,而三键是由1个 键和2个
键和2个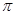 键构成的。氮气是由三键构成的,所以1mol氮气分子中含有2mol
键构成的。氮气是由三键构成的,所以1mol氮气分子中含有2mol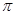 键。若该反应中有4molN-H键断裂,即有1mol肼参加反应,则生成1.5mol氮气,所以形成的
键。若该反应中有4molN-H键断裂,即有1mol肼参加反应,则生成1.5mol氮气,所以形成的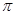 键有1.5mol×3=3mol。
键有1.5mol×3=3mol。
本题难度:一般