1、选择题 下列说法错误的是;
A.某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2
B.硅酸盐NaAlSiO4·nH2O可改写成氧化物形式为:Na2O·Al2O3·2SiO2·2nH2O
C.Al65Cu23Fe12是一种拟晶,具有合金的优良物理性能,其硬度比金属Al、Cu、Fe都大
D.过量铁与浓硫酸加热反应可以得到氢气
参考答案:A
本题解析:A.某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的SO2,发生反应:2SO2+2H2O+ O2=2H2SO4;由弱酸变为强酸,溶液中H+浓度增大,所以pH减小。错误。B.硅酸盐既可以用盐的形式表示,也可以用氧化物的形式表示。在用不同的形式表示时,各种元素的原子个数比相同。因此NaAlSiO4·nH2O也可改写成氧化物形式为:Na2O·Al2O3·2SiO2·2nH2O。正确。C. Al65Cu23Fe12是一种拟晶,具有合金的优良物理性能,合金具有许多优良的性能,如硬度比成分金属大,熔沸点比成分金属低等。故其硬度比金属Al、Cu、Fe都大。正确。D.铁与浓硫酸加热反应得到硫酸铁、二氧化硫和水,产生的硫酸铁与过量的Fe发生反应得到硫酸亚铁。随着反应的进行,硫酸变为稀硫酸,则是Fe与稀硫酸反应得到硫酸亚铁和氢气。因此最终可以得到氢气。正确。
本题难度:一般
2、填空题 铁及其化合物在日常生活应用广泛,请根据下列实验回答问题:
(1)钢铁的腐蚀
钢铁在潮湿的空气中被腐蚀的负极反应式为:______;将经过酸洗除锈的铁钉,用饱和食盐水浸泡后,放入如图所示装置中,下列叙述正确的是______
A.过一段时间,乙试管中的导管内水柱上升
B.甲试管中铁钉发生了化学腐蚀
C.铁钉在该装置中被腐蚀的情况随时间的延长而加快
(2)生铁中含有一种铁碳化合物X(?Fe3C).?X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是:______;X与过量浓硝酸反应后溶液中含有的盐的化学式______.
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下:
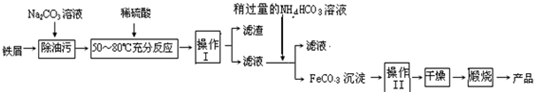
回答下列问题:
①操作Ⅰ的名称是______,操作Ⅱ的名称是______;
②Na2CO3溶液可以除油污,原因是(用离子方程式表示)______;
③请完成生成FeCO3沉淀的离子方程式:Fe2++HCO3-?FeCO3↓+______+H2O;
④写出在空气中煅烧FeCO3的化学方程式______.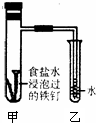
参考答案:(1)活泼金属失电子做负极,Fe-2e-=Fe2+,吸氧腐蚀时消耗氧气,故乙试管中的导管内水柱上升,
故答案为:Fe-2e-=Fe2+;A;?
(2)铁碳化合物X(?Fe3C),X在足量的空气中高温煅烧,生成有磁性的固体Y,Y为四氧化三铁,将四氧化三铁溶于过量盐酸的溶液中生成 Fe2+Fe3+H+,Fe3C与过量浓硝酸反应后生成 Fe(NO3)3,故答案为:Fe2+、Fe3+、H+;Fe(NO3)3;
(3)①分离可溶物和不溶物用过滤,除去固体上的少量可溶性杂质用洗涤,故答案为:过滤;洗涤;
②Na2CO3溶液水解显碱性故可以除油污,故答案为:CO32-+H2O?
HCO3-+OH-;
③Fe2+与HCO3-可发生双水解反应生成FeCO3,故答案为:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;
④在空气中煅烧FeCO3,FeCO3与氧气反应生成三氧化二铁和二氧化碳,故答案为:4FeCO3+O2?高温?.?2Fe2O3+4CO2.
本题解析:
本题难度:一般
3、选择题 在硫酸铁溶液中,加入a g铜,完全溶解后,又加入b g铁,充分反应后得到c g残余固体,且b<c,则下列判断正确的是? ( )
A.最后得到的溶液中含有Fe3+
B.残余固体可能为铁、铜混合物
C.最后得到的溶液中只含Cu2+
D.残余固体一定全部是铜
参考答案:B
本题解析:本题涉及的反应有:(1)Cu+2Fe3+==Cu2++2Fe2+,(2)Fe+Cu2+==Fe2++Cu,所以C不正确;由于题目中b<c,说明所加的Fe的量不确定,若Fe的量不足,说明Cu没有被全部置换出来,Cu2+ 没有完全反应掉,故残留固体全部为Cu;若Fe过量,且符合b<c,则残余固体可能为铁、铜混合物,所以B正确,D不正确;因为Fe3+能够氧化Cu,所以当残留固体中有Cu存在时,溶液中一定不含有Fe3+,所以A不正确。故选B。
点评:本题主要考查铁及其化合物的知识,要求会判断反应物与产物,题目难度中等。
本题难度:简单
4、填空题 (8分)将过量的铜置入一定量的浓硝酸中,微热,充分反应后,放出1.12 L气体(标准状况下),试回答下列问题:
(1)反应放出的气体中,含有?和?(写化学式)。
(2)完全反应后,所得溶液中的溶质是?。
(3)写出反应过程其中1个化学反应的化学方程式:?。
(4)整个反应过程中,被还原的HNO3总的物质的量是?mol。
参考答案:(共8分)(1)(2分)NO;NO2?(2)(2分)Cu(NO3)2
(3)(2分)Cu+4HNO3(浓)= Cu(NO3)2+2NO2↑+2H2O(任写1个) (4) (2分) 0.05
本题解析:(1)由于随着反应的进行,硝酸的浓度会逐渐降低,所以生成的气体由最初的NO2,逐渐过渡到NO,即生成的气体是NO2和NO的混合气。
(2)铜被硝酸氧化生成硝酸铜,且铜是过量的,所以完全反应后,所得溶液中的溶质是硝酸铜。
(3)有关反应的化学方程式是Cu+4HNO3(浓)= Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)= 3Cu(NO3)2+2NO↑+4H2O。
(4)硝酸的还原产物是NO和NO2,所以根据氮原子守恒可知,整个反应过程中,被还原的HNO3总的物质的量是1.12L÷22.4L/mol=0.05mol。
点评:该题是基础性试题的考查,试题侧重考查学生的基础性知识,同时兼顾考查学生的能力,有利于培养学生的逻辑思维能力和发散思维能力。该题难度不大,学生不难得分。
本题难度:简单
5、选择题 将a g CuO和b g Fe2O3粉末分别溶于相同体积的足量稀盐酸中,得到CuCl2和FeCl3溶液的物质的量浓度相等(忽略溶液体积的改变)。则a与b的关系为(?)
A.a=2b
B.2a=b
C.a=b
D.无法确定
参考答案:C
本题解析:略
本题难度:简单