1、选择题 0.1mol某元素的单质直接与氯气反应后,质量增加7.1g,这种元素是
A.Na
B.Mg
C.Fe
D.Al
参考答案:B
本题解析:金属与氯原子结合的物质的量之比为:
n(M):n(Cl)=0.1 mol: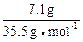 =1:2
=1:2
故氯化物的化学式为MCl2,故为B.
本题难度:简单
2、简答题 在实验室里制取少量FeCl3,可按照一定顺序连接下图中所列装置,所通过的气体过量且反应充分.试回答以下问题:
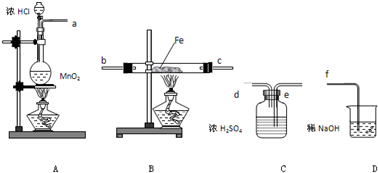
(1)实验时,各装置接口的连接顺序为______(用a、b、c、d等字母表示);
(2)C装置的作用是______;
(3)D装置的作用是______;
(4)检验B装置中反应后铁是否有剩余的方法是:______;
(5)用此方法可制得无水氯化铁.你认为能否改用Fe和盐酸反应,再通入过量氯气、蒸干溶液的方法来制取无水氯化铁,______(答:是或否);说明理由:______.
参考答案:(1)制备氯气中含有氯化氢和水蒸气,有水蒸气不能制的氯化铁,除去水蒸气用浓硫酸,应先除去水蒸气干燥,干燥的氯气通入玻璃管中和铁反应生成无水氯化铁,最后吸收尾气中未反应的氯气,防止污染空气,洗气装置导气管长进短处,导气管口连接顺序为:a?e?d?b?c?f,故答案为:a e d b c f;
(2)气体中含有水蒸气,FeCl3容易水解,C装置中是浓硫酸作用是干燥氯气,故答案为:干燥氯气;
(3)氯气有毒不能排放到空气中,氢氧化钠作用是吸收尾气氯气,防止污染空气,故答案为:吸收尾气氯气;
(4)检验B装置中反应后铁是否有剩余的方法是,用磁铁吸引产物,若被磁铁吸引,则含有铁,
故答案为:用磁铁吸引产物,若被磁铁吸引,则含有铁;
(5)改用Fe和盐酸反应生成氯化亚铁,再通入过量氯气把氯化亚铁氧化为氯化铁,因为氯化铁水解,蒸干溶液,得到的是氢氧化铁;不能来制取无水氯化铁,
故答案为:否;由于FeCl3?水解,加热蒸干该溶液只能得到Fe(OH)3.
本题解析:
本题难度:一般
3、选择题 下列反应中,能产生烟雾的是( )
A.浓盐酸挥发
B.磷在氯气中燃烧
C.铜丝在氯气中燃烧
D.磷在氧气中燃烧
参考答案:解析:A.浓盐酸挥发出来的氯化氢气体与水蒸气结合而形成的盐酸小液滴分散在空气中形成酸雾,故A错误;
B、磷在氯气中燃烧生成的三氯化磷呈液态,在空气中形成白雾,生成的五氯化磷呈固态,在空气中形成白烟,所以形成的是白色烟雾,故B正确;
C、铜丝在氯气中燃烧生成的氯化铜是固体,所以形成的是棕色烟,故C错误;
D、磷在氧气中燃烧生成的五氧化二磷,五氧化二磷固体小颗粒分散在空气中形成白烟,故D错误;
故选B
本题解析:
本题难度:简单
4、选择题 常温下,将等体积混合的两种气体充满试管后倒立在水槽中,试管内气体体积减少最多的一组是( )
A.NO2、O2
B.C2H4、H2
C.Cl2、SO2
D.NH3、O2
参考答案:因为相同条件下,气体体积比等于物质的量之比,假设每组气体分别是按照1L和1L混合溶于水
A、NO2和O2全部溶于水的反应:4NO2+O2+2H2O=4HNO3,等物质的量通入水中,由化学方程式的定量关系可知,剩余氧气3/4L,故液体上升2L-34L=54L;
C、C2H4和H2不溶于水,也不与水反应,剩余气体2L,所以液体上升为0;
C、C12和SO2全部溶于水发生反应:C12+SO2+2H2O=H2SO4+2HCI,由化学方程式的定量关系可知,气体全部反应,液体充满试管,故液体上升2L;
C、NH3和O2中氨气会全部溶于水,O2不溶于水也不与水反应,剩余NO气体1L,所以液体上升2L-1L=1L;
综上所述,液体上升高度最大的是2L,
故选C.
本题解析:
本题难度:一般
5、选择题 如图:A处通入氯气。关闭B阀时,C处红色布条无变化,打开B阀时,C处红色布条褪色。由此作出的判断正确的是(? )
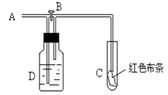
A.D中不可能是浓硫酸
B.通入的氯气含有水蒸气
C.D中不可能是NaOH溶液
D.D中可以是饱和食盐水
参考答案:B
本题解析:A处通入氯气。关闭B阀时,C处红色布条无变化,这说明氯气通入到D中,氯气要么被吸收,要么被干燥,所以选项A、C、D都是错误的。又因为打开B阀时,C处红色布条褪色,所以氯气中含有水蒸气,答案选B。
点评:该题是中等难度的试题,试题注重基础,侧重能力的培养和方法指导。有利于培养学生的逻辑思维能力和创新思维能力。该题的关键是明确氯气没有漂泊性,真正起漂白作用的是氯气和水反应生成的次氯酸。
本题难度:简单