1、选择题 向300mL KOH溶液中缓慢通入2.24L(标准状况) CO2气 体,充分反应后,在减压低温下蒸发溶液,得到19.4g白色固体。则下列说法中正确的是?(?)
体,充分反应后,在减压低温下蒸发溶液,得到19.4g白色固体。则下列说法中正确的是?(?)
A.此白色固体仅含K2CO3
B.此白色固体是K2CO3和KHCO3的混合物
C.原溶液中含KOH的质量是11.2g
D.原KOH溶液的物质的量浓度是1 mol/L
参考答案:D
本题解析:略
本题难度:简单
2、实验题 给你提供40 g NaOH固体、足量的蒸馏水和足量的CO2气体,你怎样把NaOH完全转化成Na2CO3?
参考答案:将40 g NaOH固体溶于足量的蒸馏水中,取所得溶液的 ,通入足量CO2后,(溶液不可残留CO2气体)与另
,通入足量CO2后,(溶液不可残留CO2气体)与另 溶液充分混合即可。
溶液充分混合即可。
本题解析:由NaOH+CO2====NaHCO3,NaHCO3+NaOH====Na2CO3+H2O可以设计方案。
本题难度:简单
3、计算题 KOH和KHCO3固体的混合物25.6 g,于250 ℃进行煅烧,冷却后混合物质量损失了4.9 g。
(1)求起始混合物的百分组成。
(2)若混合物的质量损失改为2.1 g,这时起始混合物的百分组成又是多少?
参考答案:21.875%和78.125%;45.6%和54.4%。
本题解析:用“差量法”判断谁过量。
假设25.6 g混合物是由KOH和KHCO3恰好完全反应的质量比混合而成的,则

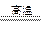 K2CO3+H2O?差量
K2CO3+H2O?差量
156? 18
25.6 g? x
经计算,求得理论差量x="2.95" g。
题目中,第一种情况实际差量>2.95 g,为KHCO3过量。由“钾守恒”,残留的固体25.6 g-4.9 g="20.7" g为K2CO3,则通过列二元方程组,可求得KOH和KHCO3固体各自的质量。题目中,第二种情况实际差量<2.95 g,为KOH过量,由方程式运算可直接求得KHCO3的质量。
本题难度:简单
4、选择题 一定温度下,m g下列物质在足量的氧气中充分燃烧后,产物与足量的过氧化钠充分反应,过氧化钠增加了n g,且n>m,符合此要求的物质是
①H2 ?②CO ?③CO和H2的混合物 ?④HCOOCH3?⑤CH3CHO
A.⑤
B.①②
C.①②③④
D.①②③④⑤
参考答案:A
本题解析:氢气燃烧生成水,水和过氧化钠反应又产生氧气,所以过氧化钠增加的质量就是氢气的质量。同样分析CO燃烧后再与过氧化钠反应,增加的质量也是CO的质量。HCOOCH3 可以看作是2H2·2CO,所以④燃烧后再与过氧化钠反应,增加的质量也是HCOOCH3的质量。所以①②③④增加的质量都是自身的质量。CH3CHO可以看作是2H2·CO·C,所以增加的质量大于自身的质量,答案选A。
本题难度:简单
5、选择题 当一小块金属钠久置在潮湿的空气中,可能有如下现象产生:①生成白色粉未;②表面变暗;③生成白色块状固体;④发生潮解,表面产生液体。这些现象的先后顺序为( )
A.①②③④
B.②④③①
C.②①③④
D.④②③①
参考答案:B
本题解析:钠放置在空气中发生的变化为Na Na2O
Na2O NaOH(s)
NaOH(s) NaOH(aq)
NaOH(aq) Na2CO3·10H2O
Na2CO3·10H2O  Na2CO3。
Na2CO3。
点评:氧化钠与二氧化碳和水都反应,但更易与水反应。
本题难度:一般