1、选择题 a?mL三种气态烃的混合物与足量的氧气混合点燃爆炸后,恢复到原来的状态(常温、常压),体积共缩小2a?mL.则三种烃可能是
A.CH4、C2H4、C3H4
B.C2H6、C3H6、C4H6
C.CH4、C2H6、C3H8
D.C2H4、C2H2、CH4
参考答案:A
本题解析:分析:设烃的混合物的平均化学式为CxHy,在氧气中燃烧的化学方程式为CxHy+(x+ )O2
)O2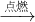 xCO2+
xCO2+ H2O(l),根据体积变化,利用差量法计算.
H2O(l),根据体积变化,利用差量法计算.
解答:设混合烃的平均组成为CxHy,根据完全燃烧通式
CxHy+(x+ )O2
)O2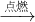 xCO2+
xCO2+ H2O(l)△V
H2O(l)△V
1? ?1+
a? 2a
则1+ =2 解得y=4
=2 解得y=4
即混合气体分子中平均含有4个H原子.
故选:A.
点评:本题考查混合物的计算,题目难度中等,注意利用差量法计算.
本题难度:困难
2、选择题 将下列物质按酸、碱、盐、氧化物分类依次排列.正确的是
A.硫酸、纯碱、石膏、臭氧
B.氢硫酸、烧碱、绿矾、干冰
C.石炭酸、乙醇、醋酸钠、水
D.磷酸、熟石灰、苛性钾、过氧化钠
参考答案:B
本题解析:分析:根据物质的分类和酸、碱、盐以及氧化物的概念进行分类,酸指电离出的阳离子全部为氢离子的化合物;碱指电离出的阴离子全部为氢氧根离子;盐是由金属阳离子或铵根离子与酸根组成的化合物;氧化物有两种元素组成,且有一种为O元素,且表现负价.
解答:A.纯碱是碳酸钠,属于盐;臭氧属于单质,故A错误;
B.氢硫酸属于酸,烧碱是氢氧化钠,属于碱,绿矾是FeSO4?7H2O,属于盐,干冰是二氧化碳,属于氧化物,故B正确;
C.石碳酸是苯酚,属于酸;乙醇是非电解质,不属于碱;醋酸钠属于盐,水属于氧化物,故C错误;
D.磷酸属于酸,熟石灰是氢氧化钙,属于碱;苛性钾是氢氧化钾,属于碱;过氧化钠属于氧化物,故D错误;
故选B.
点评:本题考查酸、碱、盐以及氧化物的概念及分类,难度不大,注意把握概念,从电离的角度把握酸碱盐的实质,注意识记物质的俗称.
本题难度:困难
3、选择题 下列离子方程式书写正确的是
A.硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+→BaSO4↓
B.稀硝酸中加入少量碳酸亚铁:FeCO3+2H+→Fe2++CO2↑+H2O
C.硫酸氢铵溶液中滴入几滴氢氧化钠溶液:H++OH-═H2O
D.饱和碳酸钠溶液中通入二氧化碳气体:2Na++CO32-+CO2+H2O═2NaHCO3↓
参考答案:CD
本题解析:分析:A.漏写生成氢氧化铜的离子反应;
B.发生氧化还原反应硝酸铁、NO、二氧化碳、水;
C.滴入几滴氢氧化钠溶液,先发生氢离子与碱的反应;
D.饱和碳酸钠溶液中生成碳素氢钠,其溶解度小,析出晶体.
解答:A.硫酸铜溶液与氢氧化钡溶液反应的离子反应为Cu2++2OH-+SO42-+Ba2+═BaSO4↓+Cu(OH)2↓,故A错误;
B.稀硝酸中加入少量碳酸亚铁的离子反应为3FeCO3+NO3-+10H+═3Fe3++3CO2↑+5H2O+NO↑,故B错误;
C.硫酸氢铵溶液中滴入几滴氢氧化钠溶液的离子反应为H++OH-═H2O,故C正确;
D.饱和碳酸钠溶液中通入二氧化碳气体的离子反应为2Na++CO32-+CO2+H2O═2NaHCO3↓,故D正确;
故选CD.
点评:本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,注意选项B为解答的难点,选项D为易错点,题目难度中等.
本题难度:一般
4、选择题 下列反应的离子方程式书写正确的是
A.过量的铁与浓硝酸反应:Fe+6H++3NO3-=Fe3+?十3NO2↑+3H2O
B.次氯酸钙溶液中通入过量CO2:ClO-+CO2+H2O=HClO+HCO3-
C.1mol?L-1?的?NaAlO2?溶液和2.5mol?L-1?的盐酸等体积混合:2AlO2-+5?H+=Al(OH)3↓+Al3++H2?O
D.在碳酸氢镁溶液中加入足量Ca(OH)2?溶液:Mg2++2HCO3-+Ca2++2OH-=MgCO3↓+CaCO3↓+2H2O
参考答案:BC
本题解析:分析:A.过量的铁会和+3价的铁离子发生氧化还原反应生成+2价的铁离子;
B.碳酸的酸性比次氯酸强,碳酸钙和二氧化碳和水反应生成易溶于水的碳酸氢钙;
C.NaAlO2?溶液和盐酸混合,生成氢氧化铝沉淀,当盐酸过量时,生成的氢氧化铝溶解;
D.碳酸镁的溶解度比氢氧化镁的溶解度大,在足量的氢氧根溶液中,镁离子应以氢氧化镁的形式沉淀;
解答:A.该选项中的离子反应方程式为少量的铁与浓硝酸的反应.当铁过量时,铁具有还原性,+3价的铁离子具有氧化性,Fe+2Fe3+═3Fe2+,过量的铁与浓硝酸反应:Fe+4H++2NO3-=Fe2+?十2NO2↑+2H2O,故A错误;
B.次氯酸钙溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O=2HClO+CaCO3↓,继续通二氧化碳至过量,CaCO3++CO2+H2O=Ca2++2HCO3-,两反应式相加除以2,得次氯酸钙溶液中通入过量CO2:ClO-+CO2+H2O=HClO+HCO3-,故B正确;
C.设取1升溶液,1mol?L-1?的?NaAlO2?溶液和2.5mol?L-1?的盐酸分别含偏铝酸钠和盐酸分别为:1mol,2.5mol,根据反应:NaAlO2+HCl+H2O═NaCl+Al(OH)3↓①,Al(OH)3+3HCl═AlCl3+3H2O②,按①反应的偏铝酸钠和盐酸分别为:1mol、1mol,同时生成1mol氢氧化铝,按②反应的盐酸和氢氧化铝分别为1.5mol、0.5mol,最终剩余0.5mol的氢氧化铝,生成0.5mol的氯化铝,总反应为:2AlO2-+5?H+=Al(OH)3↓+Al3++H2O,故C正确;
D.MgCO3微溶于水,Mg(OH)2难溶于水,在碳酸氢镁溶液中加入足量Ca(OH)2?溶液,反应为:2Ca2++Mg2++4OH-+2HCO3-=Mg(OH)2↓+2CaCO3↓+2H2O,故D错误;
故选BC.
点评:该题主要考查了当反应物的量不同时,发生的反应不同,反应方程需根据反应的量来定,做题时,需关注反应物的物质的量.
本题难度:困难
5、选择题 下列离子方程式书写正确的是
A.FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl-
B.澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O
C.FeS固体放入稀硝酸溶液中:FeS+2H+=Fe2++H2S↑
D.AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O
参考答案:B
本题解析:分析:A、离子方程式中电荷不守恒;
B、酸式盐和碱反应,量少的全部反应,离子方程式中符合化学式组成比;
C、硝酸具有强氧化性能氧化硫化亚铁;
D、氢氧化铝不溶于氨水弱酸;
解答:A、FeCl2溶液中通入Cl2:2Fe2++Cl2=2Fe3++2Cl-,故A错误;
B、澄清石灰水与少量小苏打溶液混合,反应的离子方程式为:Ca2++OH-+HCO3-=CaCO3↓+H2O,故B正确
C、FeS固体放入稀硝酸溶液中,稀硝酸具有强氧化性,能氧化硫化亚铁为三价铁离子和硫酸,故C错误;
D、AlCl3溶液中加入过量氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;故D错误;
故选B.
点评:本题考查了离子方程式的正误判断和书写方法,主要考查氧化还原反应的电子守恒,关键是稀硝酸的强氧化性,氢氧化铝不溶于弱碱.
本题难度:一般