|
高中化学知识点大全《认识晶体》高频试题预测(2017年最新版)(十)
2017-11-05 22:33:51
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 某固体仅由一种元素组成,其密度为5.0g·cm-3。用X射线研究该固体的结构得知:在边长为10-7cm的正 方体中含有20个原子。则此元素的相对原子质量最接近于下列数据中的
[? ]
A.32
B.120
C.150
D.180
参考答案:C
本题解析:
本题难度:一般
2、选择题 石墨晶体为层状结构,每一层均为碳原子与周围其他3个碳原子相结合而成平面片层,同层相邻碳原子间距142pm、相邻片层间距为335pm.如图是其晶体结构片层俯视图.下列说法不正确的是( )
A.碳以sp2杂化
B.每个碳形成3个σ键
C.石墨碳原子数与σ键数之比为2:3
D.片层之间碳成共价键
| 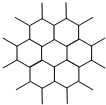
参考答案:D
本题解析:
本题难度:简单
3、填空题 (15分)可以由下列反应合成三聚氰胺:CaO+3CCaC2+CO↑,CaC2+N2CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:______________________________________________________________________。
CaCN2中阴离子为CN,与CN互为等电子体的分子有N2O和________(填化学式),由此可以推知CN的空间构型为________。
(2)尿素分子中C原子采取________杂化。尿素分子的结构简式是________________。
(3)三聚氰胺 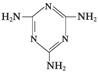 俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸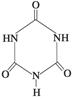 后, 后,
三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为______________。
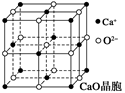
已知CaO晶体的密度为ρ,求晶胞中距离最近的两个钙离子之间的距离 ________________?__(列出计算式)
CaO晶体和NaCl晶体的晶格能分别为:CaO 3 401 kJ·mol-1、NaCl 786 kJ·mol-1。导致两者晶格能差异的主要原因是______________?______。
参考答案:(1)1s22s22p63s23p63d104s2或[Ar]3d104s2 (2分)? CO2(1分)?直线形 (1分)
(2)sp2 (1分)COH2NNH2?(2分)? (3)分子间氢键?(1分)(4)6 (2分)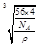 ?(3分) ?(3分)
CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量(2分)
本题解析:
(1) Ca在第四周期,核外有四层电子,最外层2个电子,则内层排满电子的基态原子的电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2,CN带16个电子,与CN互为等电子体的分子海有CO2,由此可以推知CN的空间构型与CO2相似为直线形;
(2) 尿素分子中C原子与氧原子结合成双键,与两个氮原子结合成单键,采取sp2杂化,尿素分子的结构简式为COH2NNH2;
(3) 聚氰胺分子中含有N元素,相互之间可通过分子间氢键结合;
(4) 由图可知,CaO晶体中Ca2+的配位数为6, CaO晶体和NaCl晶体都是离子晶体,晶格能差异的主要原因是CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量。
点评:本题考查物质的结构,涉及到分子结构、杂化轨道等抽象内容,具有一定难度。但此类题目近年来在高考中已被逐渐淡化。解答此类题型,要求考生具有丰富的想象力。
本题难度:一般
4、选择题 下列说法中正确的是
A.C60气化和I2升华克服的作用力相同
B.分子晶体在水溶液中一定导电
C.氯化钠和氯化氢溶于水时,破坏的化学键都是离子键
D.用作高温结构陶瓷材料的Si3N4固体是分子晶体
参考答案:A
本题解析:B项:分子晶体在熔融状态下都不导电,在水溶液中不都导电,主要看它是不是电解质,大多数非金属单质及其形成的化合物如干冰(CO2)、I2、HF、H2O、NH3、CH3CH2OH大多数有机物,其固态均为分子晶体。它们的水溶液几乎都导电。比如酸类的就导电,而蔗糖也是分子晶体但他水溶液不导电,故错;C项:氯化氢溶于水破坏的是共价键,故错;D项:Si3N4是原子晶体,故错。故选A。
点评:本题考查的是分子间作用力、分子晶体、原子晶体和化学键的相关知识,比较综合,题目难度适中。
本题难度:一般
5、选择题 下列物质的按熔沸点升高顺序排列的是
A.Li Na K Rb
B. NaF NaCl NaBr NaI
C.F2 Cl2 Br2 I2
D.H2O H2S H2Se H2Te
参考答案:C
本题解析:碱金属自上而下熔沸点逐渐降低,A不正确。氟化钠中离子键最强,所以选项B中熔沸点逐渐降低,不正确。第ⅦA自上而下单质熔沸点逐渐升高,C正确。水中含有氢键,在选项D中水的熔沸点最高,不正确。答案选C。
本题难度:简单
| 