1、实验题 Na2CO3固体中混有少量NaHCO3,除去杂质的方法是_____________________,反应方程式为______________________________;NaHCO3溶液中混有少量Na2CO3,除去杂质的方法是_____________________,反应的离子方程式为________________________;除去CO2气体中少量HCl,所用试剂是_____________,反应的离子方程式为________________________。
参考答案:加热;2NaHCO3 Na2CO3+CO2↑+H2O;通入过量的CO2;CO32-+ CO2+H2O==2HCO3-;饱和的NaHCO3溶液;HCO3-+H+==H2O+CO2↑
Na2CO3+CO2↑+H2O;通入过量的CO2;CO32-+ CO2+H2O==2HCO3-;饱和的NaHCO3溶液;HCO3-+H+==H2O+CO2↑
本题解析:
本题难度:一般
2、选择题 下列离子方程式书写正确的是?
[? ]
A.钠和冷水反应?Na+2H2O=Na++2OH-+H2↑
B.铝粉投入到NaOH溶液中:2Al+2OH-══?2AlO2-+H2↑
C.AlCl3溶液中加入足量的氨水:Al3+ +?3OH-?══?Al(OH)3↓
D.FeCl2溶液跟Cl2反应:2Fe2+ +Cl2=2Fe3+ +2Cl-
参考答案:D
本题解析:
本题难度:简单
3、填空题 亚氯酸钠(NaClO2)常用于水的消毒和砂糖、油脂的漂白与杀菌。以下是用过氧化氢法生产亚氯酸钠的工艺流程图:
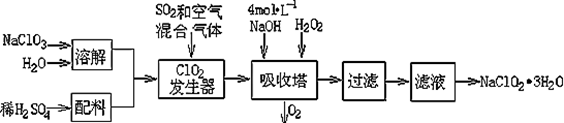
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O ;
②Ksp(FeS)=6.3×10-18 ; Ksp(CuS)=6.3×10-36 ;Ksp(PbS)=2.4×10-28
(1)吸收塔内发生反应的离子方程式为?。该工艺流程中的NaClO3、ClO2、NaClO2都是强氧化剂,它们都能和浓盐酸反应制取Cl2。若用二氧化氯和浓盐酸制取Cl2,当生成5 mol Cl2时,通过还原反应制得氯气的质量为?g。
(2)从滤液中得到NaClO2·3H2O晶体的所需操作依次是?(填写序号)。
a蒸馏;b灼烧;c过滤;d冷却结晶;e蒸发
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。
下表是 25℃时HClO2及几种常见弱酸的电离平衡常数:
?弱酸
| HClO2
| HF
| HCN
| H2S
|
Ka/mol?L-1
| 1×10-2
| 6.3×10-4
| 4.9×10-10
| K1=9.1×10?8
K2=1.1×10?12
|
?
①常温下,物质的量浓度相等的NaClO2、NaF、NaCN、Na2S四种溶液的pH由大到小的顺序为?(用化学式表示);体积相等,物质的量浓度相同的NaF、NaCN两溶液中所含阴阳离子总数的大小关系为:?(填“前者大”“相等”或“后者大”)。
②Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是?;当最后一种离子沉淀完全时(该离子浓度为10-5mol·L-1)此时体系中的S2-的浓度为?。
参考答案:(1)2ClO2 + H2O2 + 2OH- = 2ClO22—+ O2+ 2H2O;? 71 ;
(2)edc
(3)①Na2S>NaCN>NaF>NaClO2; 前者大;?② CuS; 6.3×10-13mol/L
本题解析:(1)根据题给化学工艺流程图知,吸收塔内为ClO2、氢氧化钠和过氧化氢反应生成NaClO2、氧气和水,离子方程式为2ClO2 + H2O2 + 2OH- = 2ClO22—+ O2+ 2H2O;若用二氧化氯和浓盐酸制取Cl2,二氧化氯是氧化剂,发生还原反应,浓盐酸是还原剂,发生氧化反应,根据电子守恒可知4n(ClO2)=n(HCl),还原产物与氧化产物物质的量之比为1:4,故还原反应生成的氯气为1mol,质量为71g;(2)从滤液中得到NaClO2·3H2O晶体的所需操作依次蒸发浓缩、冷却结晶、过滤,答案为edc;(3)①根据题给电离平衡常数可知酸性强弱顺序为:HClO2>HF>HCN>HS-,根据盐类水解规律:酸性越弱,对应钠盐中酸根离子水解程度越大,物质的量浓度相等的NaClO2、NaF、NaCN、Na2S四种溶液的pH由大到小的顺序为Na2S>NaCN>NaF>NaClO2;由于酸性:根据二者的水解方程式判断,体积
相等,物质的量浓度相同的NaF、NaCN溶液中阴离子总数相等;由于酸性:HF>HCN,则碱性:NaCN>NaF,NaCN溶液中氢氧根浓度大于NaF溶液中氢氧根浓度,NaCN溶液氢离子浓度较小,而两溶液中钠离子浓度相等,则溶液中阳离子总数:NaCN<NaF;溶液中所含阴阳离子总数的大小关系为:前者大;②根据阴阳离子个数比相同的难溶物,溶度积越小,溶解度越小,滴加硫化钠,相应阳离子最先沉淀,故首先析出沉淀是CuS,Fe2+最后沉淀,沉淀完全时该浓度为10-5mol?L-1,此时的S2-的浓度为6.3×10-18/10?5=6.3×10-13mol/L。
本题难度:困难
4、选择题 下列离子方程式中,正确的是( )
A.NaAlO2溶液中通入少量二氧化碳:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
B.高锰酸钾酸性溶液与草酸溶液反应:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
C.用稀硫酸除去铁片表面的铁锈:FeO+2H+=Fe2++H2O
D.用惰性电极电解饱和食盐水:2C1-+2H2O
?Cl2↑+H2↑+2OH-
参考答案:A、NaAlO2溶液中通入少量二氧化碳离子方程式为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,故A错误;
B、高锰酸钾酸性溶液与草酸溶液反应,草酸是弱电解质写化学式:2MnO4-+5H2C2O42-+6H+=2Mn2++10CO2↑+8H2O,故B错误;
C、用稀硫酸除去铁片表面的铁锈,铁锈成分是Fe2O3:Fe2O3+6H+=2Fe2++3H2O,故C错误;
D、用惰性电极电解饱和食盐水离子方程式为:2C1-+2H2O?通电?.??Cl2↑+H2↑+2OH-;故D正确;
故选D.
本题解析:
本题难度:简单
5、填空题 按要求写出对应的离子方程式
(1)写出每步现象对应的离子方程式:向FeCl3溶液中逐滴加入Na2S溶液,先产生淡黄色沉淀,后又产生黑色沉淀:_____________、_____________
(2)向明矾溶液中滴加Ba(OH)2溶液至沉淀物质的量最大:________________
(3)向碳酸氢钡溶液中滴加过量的NaOH溶液:___________________
(4)向含1molFeI2的溶液中通入1.2mol的Cl2:___________________
参考答案:(1)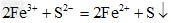 ;?
;?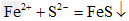 ?
?
(2)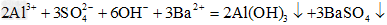 ?
?
(3)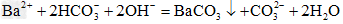
(4)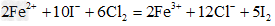
本题解析:
本题难度:一般