1、选择题 下列离子方程式正确的是(? )
A.Al与NaOH溶液反应:2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑
B.FeBr2溶液中通入少量Cl2:2Fe2++2Br-+Cl2=2Fe3++Br2+2Cl-
C.稀硝酸除银镜:Ag+2H++NO3- =Ag++NO2↑+H2O
D.烧碱溶液中通入过量SO2:2OH-+SO2=SO32-+H2O
参考答案:A
本题解析:A项表示的离子方程式正确;FeBr2溶液中通入少量Cl2,还原性强的溴离子先被氧化,所以B中氧化剂的比例错误;稀硝酸与金属反应生成生成NO气体,C错误;烧碱溶液中通入过量的SO2,生成酸式盐,所以D错误;故选择A。
本题难度:一般
2、选择题 下列离子方程式中,只能表示一个化学反应的是( )
①Fe+Cu2+═Fe2++Cu ②Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O
③Cl2+H2O═H++Cl-+HClO?④CO32-+2H+═CO2↑+H2O ⑤Ag++Cl-═AgCl↓
A.只有③
B.②③
C.③⑤
D.①④
参考答案:①表示Fe和可溶性铜盐的反应,可以是CuCl2、CuSO4等,故①错误;
②只能表示Ba(OH)2和H2SO4的一个化学反应,故②正确;
③只能表示氯气和水的一个化学反应,故③正确;
④表示可溶性碳酸盐和强酸的反应,对应的化学反应都多种,故④错误;
⑤示可溶性银盐和可溶性氯化物的反应,对应的化学反应都多种,故⑤错误.
故选B.
本题解析:
本题难度:简单
3、选择题 下列实验所对应的离子方程式正确的是(?)
A.向NaAlO2溶液中通入少量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+ HCO3-
B.向沸水中滴加饱和的氯化铁溶液:Fe3++3H2O===Fe(OH)3↓+3H+
C.在碳酸氢钡溶液中加入过量的氢氧化钠溶液:Ba2++2HCO3-+2OH-=BaCO3↓+CO32-+2H2O
D.向FeCl2溶液中加入少量K3[Fe(CN)6]溶液:4Fe2++2[Fe(CN)6]4-=Fe4[Fe(CN)6]2↓
参考答案:C
本题解析:A、向NaAlO2溶液中通入少量CO2应该生成氢氧化铝和碳酸钠,A不正确;B、向沸水中滴加饱和的氯化铁溶液生成氢氧化铁胶体,B不正确;C、在碳酸氢钡溶液中加入过量的氢氧化钠溶液生成碳酸钡、碳酸钠和水,C正确;D、向FeCl2溶液中加入少量K3[Fe(CN)6]溶液反应生成具有特征蓝色的铁氰化亚铁沉淀,离子方程式为:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓,D不正确,答案选C。
本题难度:一般
4、选择题 下列实验现象所对应的离子方程式不正确的是
?
| 实 验
| 现 象
| 离子方程式
|
A
| 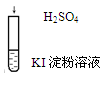
| 在空气中放置一段时间后溶液呈蓝色
| 4H+ + 4I- + O2 ="=" 2I2 + 2H2O
|
B
| 
| 开始时无气泡,后来有气泡
| CO32-+H+=HCO3-
HCO3-+H+ ="=" H2O+CO2↑
|
C
| 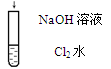
| 溶液由黄绿色变为无色
| Cl2 + 2OH- ="=" Cl- + ClO- + H2O
|
D
| 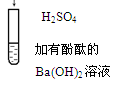
| 有白色沉淀生成,溶液由红色变为无色
| Ba2++OH-+H++SO42-="=" BaSO4↓+H2O
|
?
参考答案:D
本题解析:A、I-在酸性条件下与空气中的氧气发生氧化还原反应生成碘,溶液变蓝,正确;B、稀盐酸滴入碳酸钠溶液中,盐酸少量,开始生成碳酸氢钠,无气泡产生,继续滴加,盐酸与碳酸氢钠反应产生二氧化碳气体,正确;C、氯水呈黄绿色,加入氢氧化钠溶液后溶液为无色,是因为氯水中的氯气与氢氧化钠反应,氯气消失,溶液黄绿色消失,正确;D、离子方程式中的阴阳离子之比不符合氢氧化钡与硫酸的化学式中的阴阳离子之比,错误,答案选D。
本题难度:一般
5、选择题 下列离子方程式正确的是(?)
A.氯化铁溶液中加入过量氨水 Fe3++ 3OH- = Fe(OH)3↓
B.钠与水的反应 Na + 2H2O = Na++2OH-+H2↑
C.碳酸钙溶于稀盐酸中 CO32-+2H+=H2O+CO2↑
D.氧化镁与稀盐酸混合:MgO + 2H+= Mg2++ H2O
参考答案:D
本题解析:略
本题难度:一般