1、选择题 36 g 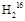 O与80 g
O与80 g 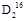 O的物质的量之比是 ,分子中所含质子数之比是 ,所含中子数之比是 ,它们分别与Na反应时,所放出气体体积之比(同条件)是 ,质量之比是 。?
O的物质的量之比是 ,分子中所含质子数之比是 ,所含中子数之比是 ,它们分别与Na反应时,所放出气体体积之比(同条件)是 ,质量之比是 。?
参考答案:1∶2 1∶2 2∶5 1∶2 1∶4
本题解析: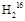 O和
O和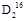 O的相对分子质量分别为18和20,所以其物质的量分别为2 mol和4 mol,质子的物质的量分别为20 mol和40 mol,中子的物质的量分别为16 mol和40 mol,与钠反应生成的气体物质的量之比与水的物质的量之比相同,气体质量之比等于气体物质的量之比再分别乘以其摩尔质量。
O的相对分子质量分别为18和20,所以其物质的量分别为2 mol和4 mol,质子的物质的量分别为20 mol和40 mol,中子的物质的量分别为16 mol和40 mol,与钠反应生成的气体物质的量之比与水的物质的量之比相同,气体质量之比等于气体物质的量之比再分别乘以其摩尔质量。
本题难度:一般
2、填空题 某100mL的CuCl2溶液中,已知溶液中的Cl-的浓度为0.2mol/L。现将一定量的铁粉投入到该溶液中,回答下列问题:(忽略反应过程中体积变化)
(1)原溶液中Cu2+的浓度为 ;(2)反应后测得Cl-的浓度为 ;
(3)若反应后测得Fe2+的溶液为0.05mol/L,则反应生成铜单质的质量为 g;
(4)剩余的Cu2+的浓度为 mol/L。
参考答案:(1)0.1 mol/L;
(2)0.2 mol/L;
(3)0.32g
(4)0.05 mol/L;
本题解析:(1)根据溶液中氯离子的浓度是0.2mol/L,可知溶液中铜离子的浓度是氯离子浓度的1/2,所以铜离子的浓度是0.2/2=0.1mol/L;
(2)氯离子在该反应中未参与反应,所以离子浓度不变,仍是0.2mol/L;
(3)若反应后测得Fe2+的溶液为0.05mol/L,溶液的体积是0.1L,则加入Fe的物质的量是0.1L×0.05mol/L=0.005mol,该反应的离子方程式为Fe+Cu2+=Cu+Fe2+,所以生成单质Cu的物质的量是0.005mol,其质量是0.005mol×64g/mol=0.32g;
(4)原溶液中铜离子的物质的量是0.1mol/L×0.1L=0.01mol,析出Cu的物质的量是0.005mol,所以溶液中剩余铜离子的物质的量是0.01-0.005=0.005mol,所以剩余铜离子的物质的量浓度是0.005mol/0.1L=0.05mol/L。
考点:考查溶液中离子浓度的计算、化学方程式的计算
本题难度:一般
3、简答题 医生通常用葡萄糖注射液维持病人血液中的血糖含量.下图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签.
葡萄糖注射液
规格:250mL
密度:1.08g?mL-1
生产批号:10032032
有效期:至2013年3月
质量分数:5%
|
某学生欲在实验室中配制500mL该葡萄糖注射液.实验用品:葡萄糖晶体(摩尔质量为180g?mol-1)、蒸馏水、烧杯、天平、药匙、胶头滴管、量筒.
(1)实验还缺少的仪器有______.
(2)下列对容量瓶及其使用方法的描述中正确的是______.
A.使用前要检查容量瓶是否漏水
B.容量瓶用蒸馏水洗净后,再用标准葡萄糖注射液润洗
C.配制溶液时,将称好的葡萄糖晶体小心倒入容量瓶中,加蒸馏水至距刻度线1~2cm时,改用胶头滴管加蒸馏水至刻度线
D.容量瓶上标明容积、温度和浓度
(3)实验中需取用______?g晶体,配制后的溶液中溶质的物质的量浓度为______.
(4)配制一定物质的量浓度的葡萄糖溶液时,下列操作使实验结果偏低的是______.
A.容量瓶中原有少量蒸馏水?B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中;
C.定容时观察液面俯视?D.定容时观察液面仰视
E.定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度,所配得溶液的浓度.
参考答案:(1)因配制一定物质的量浓度NaOH溶液步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取药品,放在小烧杯中称量,然后在烧杯中溶解(可用量筒量取水),冷却后转移到500ml容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、烧杯、药匙、玻璃棒、容量瓶、胶头滴管,故答案为:500ml容量瓶;
(2)A.使用前要检查容量瓶是否漏水,故A正确;
B.容量瓶是用来配制溶液的,不需要标准葡萄糖注射液润洗,故B错误;
C.因容量瓶不能直接用来溶解固体,故C错误;
D.容量瓶上标明容积、温度和规格,故D错误;
故选:A.
(3)葡萄糖(C6H12O6)注射液的密度为1.08g?mL-1,500mL溶液,葡萄糖的质量分数5%,则含葡萄糖的质量为:500mL×1.08g/cm3×5%=27.0g,葡萄糖的物质的量为27.0g180g/mol=0.15mol,溶质的物质的量浓度为0.15mol0.5L=0.3mol/L,故答案为:27.0;0.3mol/L;?
(4)A.容量瓶中原有少量蒸馏水,对体积和物质的量均无影响,对所配溶液浓度无影响,故A错误;?
B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中,移入容量瓶内溶质的物质的量减小,所配溶液的浓度偏低,故B正确;
C.定容时观察液面俯视,导致所配溶液的体积偏小,所配溶液的浓度偏大,故C错误;
D.定容时观察液面仰视,导致所配溶液的体积偏大,所配溶液的浓度偏小,故D正确;
E.定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度,导致所配溶液的体积偏大,所配溶液的浓度偏小,故E正确;
故选:BDE.
本题解析:
本题难度:一般
4、选择题 某溶液只含有Na+、Fe3+、Cl-、SO42-4种离子,已知溶液中Na+、Fe3+、Cl-的个数之比为3:2:1。则溶液中Fe3+和SO42-的个数之比为:
A.3:4
B.1:4
C.1:2
D.3:2
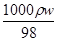 =
=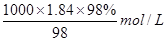 =18.4mol/L,配制1mol/L的稀硫酸100mL,需要浓硫酸的体积为V
=18.4mol/L,配制1mol/L的稀硫酸100mL,需要浓硫酸的体积为V