| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《离子共存》试题预测(2017年最新版)(六)
参考答案: 本题解析: 本题难度:困难 4、选择题 25℃时,下列各组离子在指定溶液中一定能大量共存的是 |
参考答案:C
本题解析:离子间如果发生化学反应,则不能大量共存,反之是可以的。则A、0.1 mol·L-1NaAlO2溶液中Al3+与偏铝酸根离子水解相互促进生成氢氧化铝沉淀,不能大量共存,A错误;B、加入金属铝产生H2的溶液可能显酸性,也可能显碱性。显酸性,则硝酸根与金属反应得不到去。显碱性,则NH4+不能大量共存,B错误;C、含有大量ClO-的溶液中:K+、Na+、NO3-、SO42-可以大量共存,C正确;D、0.1mol/LFeCl3溶液中SCN-不能大量共存,D错误,答案选C。
考点:考查离子共存的正误判断
本题难度:一般
5、选择题 下列关于电解质溶液的叙述正确的是
A.常温下,同浓度的Na2CO3与NaHCO3溶液相比,Na2CO3溶液的pH大
B.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(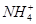 )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
C.中和pH与体积均相同的盐酸和醋酸,消耗NaOH溶液的物质的量相同
D.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低
参考答案:A
本题解析:选项A,Na2CO3的水解能力大于NaHCO3的水解能力,常温下,同浓度的Na2CO3溶液的pH大于NaHCO3溶液的。选项B,根据电荷守恒可得c(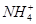 )+c(H+)=c(OH-)+c(Cl-),因c(H+)=c(OH-),所以c(
)+c(H+)=c(OH-)+c(Cl-),因c(H+)=c(OH-),所以c(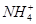 )=c(Cl-),故有c(
)=c(Cl-),故有c(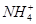 )=c(Cl-)>c(H+)=c(OH-)。选项C,pH相同的盐酸、CH3COOH溶液相比,CH3COOH的物质的量浓度远远大于HCl的物质的量浓度,所以中和等体积、等pH的盐酸、CH3COOH溶液时,CH3COOH消耗NaOH的物质的量多。选项D,稀释盐酸时,c(H+)下降,但c(OH-)上升。
)=c(Cl-)>c(H+)=c(OH-)。选项C,pH相同的盐酸、CH3COOH溶液相比,CH3COOH的物质的量浓度远远大于HCl的物质的量浓度,所以中和等体积、等pH的盐酸、CH3COOH溶液时,CH3COOH消耗NaOH的物质的量多。选项D,稀释盐酸时,c(H+)下降,但c(OH-)上升。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《有机合成与.. | |