1、选择题 根据下图,可判断出下列离子方程式中错误的是

[? ]
A.2Ag(s)+Cd2+(aq)=2Ag+(aq)+Cd(s)?
B.Cd(s)+Co2+(aq)=Cd2+(aq)+Co(s)
C.2Ag+(aq)+Cd(s)=2Ag(s)+Cd2+(aq)?
D.2Ag+(aq)+Co(s)=2Ag(s)+Co2+(aq)?
参考答案:A
本题解析:
本题难度:一般
2、选择题 在25℃时,用石墨电极电解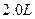 ,
,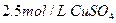 溶液。5min后,在一个石墨电极上有6.4g Cu生成。试回答:
溶液。5min后,在一个石墨电极上有6.4g Cu生成。试回答:
(1)转移电子的物质的量,得到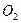 的体积(标准状况),溶液的
的体积(标准状况),溶液的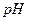 ?
?
2)如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差多少?电解液的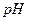 是否变化??(相对原子质量? Cu:64)
是否变化??(相对原子质量? Cu:64)
参考答案:(1)设转移电子的物质的量为x ,生成氧气的体积为V
2Cu2+ + 4e— = 2Cu
2? 4? 2
X?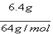 ?4:x="2:0.1mol?" ?x="0.2mol"
?4:x="2:0.1mol?" ?x="0.2mol"
根据电子守恒:4OH— — 4e—= 2H2O + O2↑
4? 4mol? 22.4L
n(OH—)? 0.2mol? V?
4mol :0.2mol =22.4L:? V=1.12L。n(H+)=n(OH—)="0.2mol" c(H+)=0.2mol/2.0L=0.1mol/L
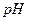 =-lgc(H+)=1.
=-lgc(H+)=1.
(2)用等质量的两块铜片代替石墨作电极,电极反应为:
阳极:Cu— 2e—=Cu2+?阴极: Cu2+ + 2e— ="?" Cu 根据转移电子守恒,阴极析出铜的质量和阳极溶解铜的质量相等,都是6.4g,电解后两铜片的质量相差为:?6.4g+6.4g=12.8g,溶液中c(H+)不变,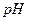 不变。
不变。
本题解析:略
本题难度:简单
3、填空题 分氨气是中学化学中常见的气体,其用途广泛。
(1)实验室制取氨气的化学方程式是?。
(2)工业上氨气可以由氢气和氮气合成。?
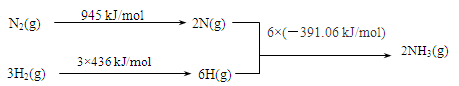
①该反应的热化学方程式是?。
②简述一种检查氨气是否泄露可采用的化学方法:?。
(3)下表是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
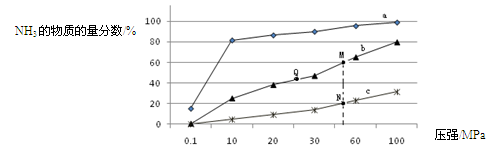
①曲线a对应的温度是?。
②关于工业合成氨的反应,下列叙述正确的是? (填字母)。
A. 及时分离出NH3可以提高H2的平衡转化率
B. 加催化剂能加快反应速率且提高H2的平衡转化率
C. 上图中M、N、Q点平衡常数K的大小关系是K(M)=" K(Q)" >K(N)
③ M点对应的H2转化率是?。
(4)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用
氨水吸收法处理尾气。
① 当氨水中所含氨的物质的量为3 mol ,吸收标准状况下44.8 L SO2时,溶液中的溶
质为?。
② (NH4)2SO3显碱性,用化学平衡原理解释?。
③ NH4HSO3显酸性。用氨水吸收SO2,当吸收液显中性时,溶液中离子浓度关系正确
的是?(填字母)。
a.c(NH4+) = 2c(SO32-) + c(HSO3-)?
b.c(NH4+)> c(SO32-)> c(H+)= c(OH-)
c.c(NH4+)+ c(H+)= c(SO32-)+c(HSO3-)+c(OH-)
(5)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:
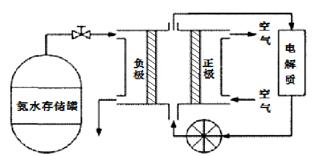
①氨气燃料电池的电解质溶液最好选择?(填“酸性”、“碱性”或“中性”)溶液。
②空气在进入电池装置前需要通过过滤器除去的气体是?。
③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池的电极总反应是?,正极的电极反应方是?。
参考答案:(1)2NH4Cl +Ca(OH)2△2NH3↑+CaCl2 +2H2O? (1分)
(2)①N2(g) +3H2(g) ?2NH3(g)?
?2NH3(g)?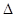 H= -93.36 kJ/mol (1分)
H= -93.36 kJ/mol (1分)
②将湿润的红色石蕊试纸接近容器,观察试纸是否变蓝,如果变蓝说明有氨气泄露。(或蘸取浓盐酸接近容器,观察是否有白烟生成,如果有白烟生成说明管道泄露。) (1分)
(3)① 200℃(1分)? ② AC(1分)? ③ 75%(1分)
(4)① (NH4)2SO3和NH4HSO3(1分)
② NH4+ + H2O NH3·H2O + H+?SO32-+H2O
NH3·H2O + H+?SO32-+H2O HSO3-+ OH-,SO32-水解程度大于NH4+的水解程度使溶液中c(OH-) > c(H+),溶液呈碱性。(1分)
HSO3-+ OH-,SO32-水解程度大于NH4+的水解程度使溶液中c(OH-) > c(H+),溶液呈碱性。(1分)
③ a? b(2分)
(5)①碱性(1分? ②CO2(1分) ③ 4NH3+ 3O2= 2N2 + 6H2O (1分)?
3O2 + 12e-+ 6H2O = 12OH-(1分)或? O2 + 4e-+ 2H2O = 4OH-
本题解析:(1)实验室制取氨气的化学方程式是2NH4Cl +Ca(OH)2△2NH3↑+CaCl2 +2H2O。
(2)①该反应的△H="945" kJ/mol+3×(436 kJ/mol)-6×(-391.06 kJ/mol)=-93.36 kJ/mol。
②检查氨气是否泄露有:将湿润的红色石蕊试纸接近容器,观察试纸是否变蓝,如果变蓝说明有氨气泄露。(或蘸取浓盐酸接近容器,观察是否有白烟生成,如果有白烟生成说明管道泄露。
(3)①曲线a的NH3的物质的量分数最大,而合成氨为放热反应,故对应的温度最低,是200℃。
②A.及时分离出NH3可以使平衡正向移动,可以提高H2的平衡转化率;
B. 加催化剂能加快反应速率,但不能破坏破坏,不能提高H2的平衡转化率;
C.合成氨为体积缩小的反应,压强越高平衡常数K越大,故K(M)=" K(Q)" >K(N)。
③N2(g) +3H2(g) ?2NH3(g)
?2NH3(g)
1? 3? 0
变化:1x? 3x? 2x
M点对应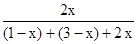 ?=60%,H2转化率75%。
?=60%,H2转化率75%。
(4)① 当氨水中所含氨的物质的量为3 mol ,吸收标准状况下44.8 L即2molSO2时,溶液中的溶
质含NH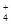 与S的个数比为3:2,故是1:1的(NH4)2SO3和NH4HSO3。
与S的个数比为3:2,故是1:1的(NH4)2SO3和NH4HSO3。
② (NH4)2SO3显碱性,是SO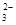 水解的缘故。
水解的缘故。
③ NH4HSO3显酸性。用氨水吸收SO2,当吸收液显中性时,
a.因为c(NH4+)+ c(H+)= 2c(SO32-) + c(HSO3-)+ c(OH-),中性得出c(NH4+) = 2c(SO32-)+ c(HSO3-);
b.NH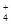 为盐直接电离的离子,SO
为盐直接电离的离子,SO 是HSO
是HSO 电离的离子,即c(NH4+)> c(SO32-);
电离的离子,即c(NH4+)> c(SO32-);
c.由电荷守恒:c(NH4+)+ c(H+)="2" c(SO32-)+c(HSO3-)+c(OH-)
(5)③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体是N2和水,即4NH3+ 3O2= 2N2 + 6H2O,正极的电极反应方是O2 + 4e-+ 2H2O = 4OH-
本题难度:简单
4、选择题 如下图所示为氢氧燃料电池的原理示意图,按照此图的提示,下列叙述不正确的是(?)
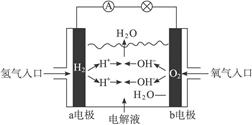
A.a电极是负极
B.b电极的电极反应为:4OH--4e-====2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
参考答案:B
本题解析:原电池中分解失去电子,发生氧化反应,逐渐得到电子,发生还原反应。A项H2失电子变成H+,作负极。B项电极反应式应该是O2+4e-+2H2O====4OH-,作正极,选项B不正确。C项绿色电源即无污染电源。D项正确,所以正确的答案选B。
本题难度:一般
5、选择题 如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1 mol时,下列说法不正确的是
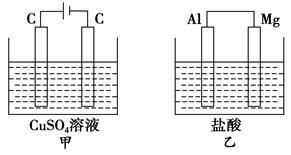
A.溶液的质量变化:甲减小乙增大
B.溶液pH变化:甲减小乙增大
C.相同条件下产生气体的体积:V甲=V乙
D.电极反应式:甲中阴极为Cu2++2e-===Cu,乙中负极为Mg-2e-===Mg2+