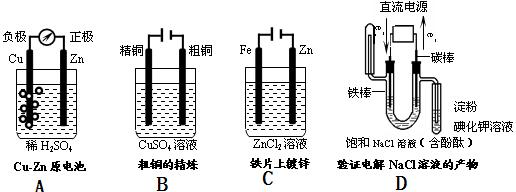
1、填空题 (12分)(1).下列有关电化学的图示中,完全正确的是?
(2).碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中可与碘化物作用生成单质碘。以碘为原料,通过电解制备碘酸钾的实验装置如图所示。
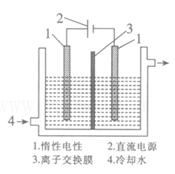
请回答下列问题:
a、碘是?(填颜色)固体物质,实验室常用?方法来分离提纯含有少量泥沙杂质的固体碘。
b、电解前,先将一定量的精制碘溶于过量氢氧化钾溶
液,溶解时发生反应:3I2+6KOH==5KI+KIO3+3H2O,
将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。
电解时,阳极上发生反应的电极反应式为?,每生成1mol KIO3,电路中通过的电子的物质的量为___________________。
c、电解过程中,为确定电解是否完成,需检验电解液中是否有I-。请设计一个检验
电解液中是否有I-的简单实验方案,并按要求填写下表。
可供选择的试剂有淀粉溶液,稀硫酸,氯化钠溶液,酒精等。(用其中的一种或多种均可。)
d、电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:
阳极电解液→①蒸发浓缩→②→③过滤→④洗涤→⑤→碘酸钾晶体
步骤②的操作名称是?,步骤⑤的操作名称是?。步骤④洗涤
晶体的目的是?。
参考答案:(12分)
a、紫黑色(1分)升华(或加热)(1分)b、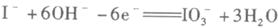
(2分),6mol(1分) c、
实验方法
实验现象及结论
取少量阳极区电解液于试管中,加稀硫酸酸化后加入几滴淀粉溶液,观察是否变蓝。
如果不变蓝,说明无I-,;若变蓝,说明有I-。
d、冷却结晶,干燥,洗去吸附在碘酸钾晶体上的氢氧化钾等杂质。
本题解析:略
本题难度:一般
2、选择题 右图为铜锌原电池示意图,下列说法正确的是
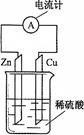
A.电子由铜片通过导线流向锌片
B.烧杯中溶液逐渐呈蓝色
C.锌片逐渐溶解
D.该装置能将电能转变为化学能
参考答案:C
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铜活泼,所以锌是负极,铜是正极,溶液中的氢离子再正极得到电子,所以AB不正确,C正确。原电池是把化学能转化为电能的装置,D不正确,答案选C。
本题难度:简单
3、选择题 把a、b、c、d四块金属浸泡在稀H2SO4中,用导线两两相连,可组成各种原电池.若把a、b连接时,a为负极;若把c、d连接时,在d上冒气泡;当把a、c相连时,a溶解;当把b、d相连时,b为正极.则a、b、c、d的活动性顺序由大到小是( )
A.a、b、c、d
B.a、c、d、b
C.c、a、b、d
D.b、d、c、a?
参考答案:原电池中,负极材料为较为活泼的金属,则a、b连接时,a为负极,则活动性a>b;
若把c、d连接时,在d上冒气泡,则d为正极,活动性c>d;
当把a、c相连时,a溶解,则a为负极,活动性a>c;
当把b、d相连时,b为正极,则活动性d>b,
则有活动性:a>c>d>b,
故选B.
本题解析:
本题难度:简单
4、填空题 (1)蕴藏在海底的“可燃冰”是在高压下形成的外观像冰的甲烷水合物固体,我国南海海底有极其丰富的“可燃冰”资源。将“可燃冰”从海底取出时易融化,释放出的甲烷气体将泄漏于大气中而产生严重的环境问题,这是目前开采“可燃冰”遇到的技术难题,请据此回答:
①甲烷气体泄漏于大气中会造成怎样的环境问题?答:? ?。
②请你运用所学的物质结构知识解释“可燃冰”为何易融化放出气体?
答:?。
(2)设计出燃料电池使液化石油气氧化直接产生电流是新世纪最富有挑战性的课题之一。最近有人设计了一种燃料电池,一个电极通入空气,另一个电极通入液化石油气(以C4H10表示),电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。
①已知该电池的负极反应为:C4H10+13O2--26e-?4CO2+5H2O,则该电池的正极反应式为? ?,电池工作时,固体电解里的O2-向?极移动。
②液化石油气燃料电池最大的障碍是氧化还原不完全而产生的? ?(填写物质的名称)堵塞电极的通气管道。
(3)能源的紧缺在很大程度上制约了我国的经济发展,请你提出解决能源紧缺问题的两点建议:①? ?,
②? ?。
参考答案:(1)①温室效应(1分)
②“可燃冰”是分子晶体,分子间存在较弱的分子间作用力,故“可燃冰”的熔沸点较低 (1分)
(2)①O2+4e-====2O2-(2分)?负(1分)?②固体碳(1分)
(3)①寻找新能源(1分)?②提高燃料的利用率(1分)
本题解析:(1)物质熔沸点高低的判断、易挥发、易液化等问题都与构成物质的微粒间相互作用的强弱有关。
(2)根据燃烧方程式推得总反应式为? C4H10+ 13/2 O2 → 4 CO2+ 5 H2O
减去负极反应式? C4H10+13O2--26e-?4CO2+5H2O
13/2 O2-(13O2--26e-)=0?整理得: O2+4e-=O2-
本题难度:一般
5、选择题 氧化反应和还原反应分别在两个电极上自发进行时,便能构成原电池反应.下列氧化反应,在一定条件下不能构成原电池反应的是( )
A.2FeCl3+Fe═3FeCl2
B.H2SO4+2NaOH═Na2SO4+2H2O
C.Cl2+2NaOH═NaCl+NaClO+H2O
D.2H2+O2═2H2O
参考答案:A.该反应中,铁元素的化合价由0价、+3价变为+2价,且该反应是自发进行的氧化还原反应,氧化剂和还原剂是不同物质,所以能构成原电池,故A不选;
B.该反应中各元素的化合价都不变,所以不是氧化还原反应,则不能构成原电池,故B选;
C.该反应中,氯元素的化合价由0价变为-1价和+1价,该反应是自发进行的氧化还原反应,但氧化剂和还原剂是同一物质,所以不能构成原电池,故C选;
D.该反应中,O元素的化合价由0价变为-2价,H元素的化合价由0价变为+1价,且该反应是自发进行的氧化还原反应,氧化剂和还原剂不是同一物质,所以能构成原电池,故D不选;
故选BC.
本题解析:
本题难度:简单