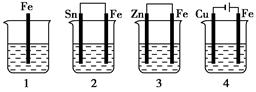
1、选择题 如下图所示,各容器中盛有海水,铁在其中被腐蚀时,由快到慢的顺序是( )
A.4>2>1>3
B.2>1>3>4
C.4>2>3>1
D.3>2>4>1
参考答案:A
本题解析:以1作参考。2中构成了原电池,金属活动性Fe>Sn,所以Fe作原电池的负极,Fe反应腐蚀的速率比1快;3中构成了原电池,由于金属活动性Zn>Fe,所以Fe作原电池的正极,首先被你氧化的是Zn,所以Fe被腐蚀的反应速率比1慢;4是电解池,Fe与电源的正极连接,作阳极,发生的反应:Fe-2e-=Fe2+。Fe腐蚀的速率比2快。因此铁在其中被腐蚀时,由快到慢的顺序是4>2>1>3。选项为A.。
本题难度:一般
2、选择题 下列事实不能用电化学理论解释的是( )
A.轮船水线以下的船壳上装一定数量的锌块
B.红热的铁丝与冷水接触,表面形成蓝黑色保护层
C.纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快
D.镀锌的铁比镀锡的铁耐用
参考答案:A、轮船水线下的船壳装上锌块后,可保护船壳在海水中不被腐蚀,因为Zn比Fe活泼,Zn与Fe构成原电池,在海水中锌被腐蚀,从而保护船壳,发生原电池反应可用电化学知识解释,故A错误;
B、金属铁在高温下可以和水反应生成四氧化三铁黑色固体,此现象与电化学知识无关,故B正确;
C、纯Zn和稀H2SO4反应速率慢,滴入CuSO4后,发生Zn+Cu2+=Zn2++Cu的反应,生成的Cu和Zn组成原电池,加快Zn与H2SO4的反应速率;发生原电池反应而可用电化学知识解释,故C错误;
D、镀锌铁发生金属被腐蚀现象时,因Zn比Fe活泼,Zn被腐蚀,镀锡铁破损后发生电化腐蚀,因Fe比Sn活泼,因而是铁被腐蚀.所以,镀锌铁比镀锡铁耐用,发生原电池反应而可用电化学知识解释,故D错误.
故选B.
本题解析:
本题难度:一般
3、填空题 钢铁在潮湿的空气里容易发生电化学腐蚀,负极发生反应的电极反应式为______,如果水膜的酸性较强,则正极的电极反应式为______.
参考答案:钢铁在潮湿的空气中发生吸氧腐蚀,负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-=Fe2+,正极上得电子发生还原反应;
如果水膜的酸性较强,则发生析氢腐蚀,负极上铁失电子发生氧化反应,正极上氢离子得电子发生还原反应,电极反应式为:2H++2e-=H2↑,
故答案为:Fe-2e-=Fe2+,2H++2e-=H2↑.
本题解析:
本题难度:一般
4、选择题 下列说法不正确的是
[? ]
A.铁管道与直流电源负极相连,防止铁管道腐蚀
B.小苏打、氢氧化铝可用于治疗胃酸过多
C.工业生产中,常将氯气通入澄清石灰水中,制取漂白粉
D.除去氯化钙溶液中的少量盐酸,加入足量碳酸钙粉末,充分搅拌再过滤
参考答案:D
本题解析:
本题难度:简单
5、填空题 (8分)化学电源在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O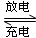 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是?(填序号)
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是?(填序号)
①以上反应不是可逆反应②电解质溶液为硫酸
③充电时化学能转变为电能?④镉(Cd)为负极,发生还原反应
⑤放电时正极区pH升高
(2)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源。氢氧燃料电池的突出优点是把化学能直接转化为电能,而不经过热能中间形成,发生的反应为: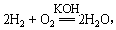 则负极反应式为___?_____________?_,正极反应式为?。一段时间后,KOH溶液的浓度?(填“变大”、“变小”或“不变”)
则负极反应式为___?_____________?_,正极反应式为?。一段时间后,KOH溶液的浓度?(填“变大”、“变小”或“不变”)
参考答案:(每空2分)(1)①⑤?(2)H2-2e–+2OH—=2H2O? O2+2H2O+ 4e– =4OH–?变小
本题解析:考查电化学的综合应用。
(1)应用放电和充电的反应条件不同,所以反应不是可逆反应,选项①正确;Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,所以电解质不能用硫酸,选项②不正确;充电相当于电解,电能转化为化学能,选项③不正确;放电是镉失去电子,发生氧化反应,作负极,选项④不正确;放电时正极电极反应式是2NiO(OH)-+2e-+2H2O=2OH-+2Ni(OH)2,所以放电时正极区pH升高,选项⑤正确,答案选①⑤。
(2)原电池负极失去电子,所以氢气在负极通入,电极反应式是H2-2e–+2OH—=2H2O;氧气在正极通入,电极反应式是O2+2H2O+ 4e– =4OH– 。由于反应中有水生成,所以氢氧化钾的浓度降低,pH变小。
本题难度:一般