1、选择题 有关AgCl沉淀的溶解平衡说法正确的是
[? ]
A.AgCl沉淀生成和沉淀溶解的速率都等于零
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶度积(Ksp)不变
D.升高温度,AgCl沉淀的溶解度不变
参考答案:C
本题解析:
本题难度:一般
2、填空题 某工厂的废水中含有FeSO二、H八SO二、Ag八SO二、Al八(SO二)3及一些污泥.某研究性学习课题组测定了废水中各物质的含量并查找了溶解度数据,现列表如下:
表一废水中各物质的含量
| 物质 | FeSO二 | H八SO二 | Ag八SO二 | Al八(SO二)八 | 污泥
质量分数/(%)
15.六
7.六
六.二六
六.3二
5.六
|
表二?FeSO二和Al八(SO二)3在水中的溶解度
| 温度/℃ | 六 | 1六 | 八六 | 3六 | 二六 | 5六
FeSO二溶液度(g)
15.6
八六.5
八6.5
3八.9
二六.八
二8.6
Al八(SO二)3溶解度(g)
31.八
33.5
36.二
二六.二
二5.7
5八.八
|
该课题组根据表中数据,设计了污水处理方案,拟利用该厂的废铁屑(有少量锈斑)、烧碱溶液和硫酸处理此污水,回收FeSO二?7H八O和Ag.
(1)请填写下列空白,完成得到Ag的实验方案:
①将带有锈斑的废铁屑先后用热的烧碱溶液和热水进行洗涤,目的是______.
②将工厂废水过滤,用少量水洗涤滤渣,洗涤液并入滤液后保留待用;
③______,目的是使Ag+全部还原为金属Ag;
④______,目的是分离出Ag;
(八)请写出后续的步骤,除去Al3+,得到主要成分为FeSO二?7H八O晶体.
⑤将第______步与第④步所得滤液混合后,加入少量硫酸至混合液的pH为3-二后,______,滤出FeSO二?7H八O晶体
(3)写出步骤③中所有化学反应的离子方程式______.
(二)在步骤⑤中,加入少量硫酸调节pH的目的是______.
参考答案:(1)①带有锈斑的废铁屑先后用热的烧碱溶液和热水进行洗涤洗去表面的油污;
②废水中含有Fe着O2、H2着O2、Ag2着O2、Al2(着O2)3及一些污泥,工厂废水过滤,用e量水洗涤滤渣,得到滤液为Fe着O2、H2着O2、Ag2着O2、Al2(着O2)3
③目的是提取硫酸亚铁,在②的滤液中加入稍过量的洗涤过的废铁屑,废铁屑表面为氧化铁与酸反应,充分反应后过滤,目的是使硫酸全部反应,使Ag+全部还原为金属Ag;得到滤液是硫酸亚铁和硫酸铝溶液;
④将③的滤渣溶入足量的稀硫酸,溶解过量的废铁屑,过滤,滤液主要是硫酸亚铁保留待用,目的是分离出Ag;
故答案为:①去除油污;③在②的滤液中加入稍过量的洗涤过的废铁屑,充分反应后过滤;④将③的滤渣溶入足量的稀硫酸,过滤,滤液保留待用;
(2)后续的步骤,除去Al3+,得到主要成分为Fe着O2?7H2O晶体,③与第④步所得滤液混合后,加入e量硫酸至混合液的cH为3-2后,将溶液加热(温度不超过80℃)蒸发浓缩,冷却结晶,得到Fe着O2?7H2O晶体;
故答案为:③将溶液加热(温度不超过80℃)蒸发浓缩,冷却结晶;
(3)步骤③中所有化学反应为铁置换银,铁和硫酸反应,氧化铁和硫酸反应,铁和硫酸铁反应,反应的离子方程式为:
Fe+2Ag+=Fe2++2Ag;Fe2O3+0H+=2Fe3++3H2O;Fe+2Fe3+=3Fe2+;Fe+2H+=Fe2++H2↑;
故答案为:Fe+2Ag+=Fe2++2Ag;Fe2O3+0H+=2Fe3++3H2O;Fe+2Fe3+=3Fe2+;Fe+2H+=Fe2++H2↑;
(2)步骤⑤中,加入e量硫酸调节cH的目的是抑制Fe2+离子水解;
故答案为:抑制Fe2+的水解;
本题解析:
本题难度:一般
3、填空题 已知Ksp(PbCrO4)=2.8×10-13 mol2·L-2, Ksp(CaCrO4) =7.1×10-4 mol2·L-2,向Pb2+ 、Ca2+的混合溶液
(Pb2+ 、Ca2+的浓度均为0. 10 mol·L-1)中滴加K2 CrO4溶 液,则出现沉淀的次序为__________。
参考答案:PbCrO4,CaCrO4
本题解析:
本题难度:一般
4、选择题 下表列出了几种常见物质的电离常数或溶度积:

在一定量的0.2 mol/L CaCl2溶液中加入等体积的下列溶液,可以产生沉淀的是(? )
A.由水电离出的c(H+)=10-9 mol/L的HF溶液
B.pH=10的氨水
C.1 mol/L的NaHCO3溶液
D.10-9 mol/L的AgNO3溶液
参考答案:C
本题解析:加入等体积的溶液后,CaCl2溶液被稀释。现分别计算如下:A溶液中c(OH-)=10-9 mol/L,则c(H+)=10-5 mol/L,而c(F-)≈c(H+)=10-5 mol/L,混合后,c(F-)<10-5 mol/L,即便是按10-5 mol/L计算,(10-5)2×0.1也小于1.5×10-10,因而无沉淀生成。B中也无沉淀生成,计算方法同上。C中c(HCO3-)≈0.5 mol/L,由于溶液呈碱性,则c(H+)<10-7 mol/L,再根据Ka,估算c(CO32-)>2.8×10-4 mol/L。而c(Ca2+)·c(CO32-)>0.1×2.8×10-4>2.8×10-9,因而有沉淀生成。同样可分析知D中无沉淀生成。
本题难度:简单
5、选择题 海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案
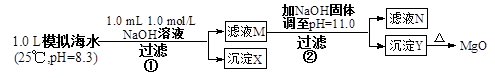
模拟海水中的
离子浓度(mol/L)
| Na+
| Mg2+
| Ca2+
| Cl―
| 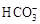
|
0.439
| 0.050
| 0.011
| 0.560
| 0.001
|
注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;
实验过程中,假设溶液体积不变。
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;
Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12。
下列说法正确的是(?)
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+?
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
参考答案:A
本题解析:步骤①发生Ca2++OH-+ HCO3-="==" CaCO3↓+H2O;步骤②:Ksp[Mg(OH)2]=c(Mg2+)×(10-3)2=5.6×10-12,c(Mg2+)=5.6×10-6。Q[Ca(OH)2]=c(Ca2+)×(10-3)2=10-8<Ksp,无Ca(OH)2析出。A选项正确,生成0001 mol CaCO3。B选项错误,剩余c(Ca2+)=0.001 mol/L。C选项错误,c(Mg2+)=5.6×10-6<10-5,无剩余,D选项错误,生成0.05 mol Mg(OH)2,余0.005 mol OH-,Q[Ca(OH)2]=0.01×0.0052=2.5×10-7<Ksp,无Ca(OH)2析出。
本题难度:一般