1、填空题 (10分)称取三份锌,分别放入三支试管中,在试管甲里加入PH=3的盐酸50ml,在试管乙里加入PH=3的醋酸50ml,在试管丙里加入PH=3的醋酸50ml及少量铜粉,塞上导管塞子,定时测定生成H2的体积。若反应终了时,生成的H2一样多,且锌没有剩余。
(1)用“>”、“=”或“<”回答以下问题:
①参加反应的锌的质量由多到少的顺序为:?。
②反应完毕时,所需反应时间由多到少的顺序为:?。
(2)简答:
①反应所需时间最长的一种酸的原因是:?。
②乙、丙反应所需时间是否相等?答:?。其原因是:?。
参考答案:(1)①甲=乙=丙?②甲>乙>丙 (2)①随着反应的进行,盐酸里[H+]减小得最多,反应速率减小最快,时间最长。②不相等,丙中形成了铜锌原电池,加速了锌的反应,丙中反应较乙中快。
本题解析:因为氢气的量相同,所以参加反应的锌的质量相等,故甲=乙=丙;因为丙反应速率最快,其次乙在反应中不停电离,保持较小的pH,而甲pH不断增大,故有:甲>乙>丙。(2)简答:①随着反应的进行,盐酸里[H+]减小得最多,反应速率减小最快,时间最长。因为丙中形成了铜锌原电池,反应速率比单比酸反应要快,加速了锌的反应,丙中反应较乙中快。
点评:高考常考知识之一,化学反应原理及分析溶液的PH的变化,平时对这类题目,要在理解基本概念的前提下,多练习,多总结,才能得心应手。
本题难度:一般
2、选择题 将pH=3的盐酸和pH=11的氨水等体积混合后,溶液中离子浓度关系正确的是
A.c(NH)>c(Cl-)>c(H+)>c(OH-)
B.c(NH)>c(Cl-)>c(OH-)>c(H+)
C.c(Cl-)>c(NH)>c(H+)>c(OH-)
D.c(Cl-)>c(NH)>c(OH-)>c(H+)
参考答案:B
本题解析:氨水是弱碱,所以pH=11的氨水的浓度大于0.001mol/L,因此在反应中氨水是过量的,溶液显碱性,答案选B。
本题难度:一般
3、选择题 25 ℃时,在20 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是( )

A.在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B.在B点:c(OH-)=c(H+),c(Na+)=c(CH3COO-)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
参考答案:A
本题解析:在A点是20 mL 0.1 mol·L-1 NaOH溶液和10 mL 0.2 mol·L-1醋酸溶液恰好反应完全,生成的醋酸钠中的醋酸根离子水解使溶液呈碱性,离子浓度的关系应该为c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故A项错误;B点时溶液为中性,c(OH-)=c(H+),由电荷守恒可得c(CH3COO-)=c(Na+),B项正确;在C点,CH3COOH过量,以CH3COOH电离为主,溶液呈酸性,故c(CH3COO-)>c(Na+)>c(H+)>c(OH-),C项正确;在C点由物料守恒可得c(CH3COO-)+c(CH3COOH)=2c(Na+),故D项正确。
本题难度:一般
4、选择题 pH=10的NaOH和pH=12的Ba(OH)2等体积混合后,溶液的pH值为
A.11.7
B.10.3
C.11.4
D.11.0
参考答案:A
本题解析:
【错解分析】(1)已知两种溶液的pH值,求混合后溶液的pH值,往往从两种酸入手。一是pH值与氢离子浓度相互换算较为简单、直观,二是计算推断与事实相符不易错。但也易形成思维定势,遇到任何两种溶液混合,先求混合液的[H+],再求其pH值。如:两种碱溶液等体积混合,由于将氢离子视为溶质,按下式求混合液的氢离子浓度:
pH=10的NaOH,其[H+]=1×10-10mol·L-1;
pH=12的Ba(OH)2,其[H+]=1×10-12mol·L-1;

=50.5×10-12mol·L-1
进而计算出混合液的pH值为10.3,得出错误选项B的结论。
实际上碱溶液的溶质应是氢氧根离子,其浓度随溶液体积变化而变化。而碱溶液中的氢离子是由水电离生成,其浓度只随上述溶质氢氧根离子浓度变化而变化,两者乘积为水的离子积。两种碱溶液混合,其溶质也应是氢氧根离子。计算混合液的氢氧根离子浓度,再由水的离子积计算氢离子浓度,进而计算混合液的pH值。
(2)由溶液pH值求出的氢离子浓度,是溶液中已电离的氢离子浓度,对于多元强酸来说,它应是酸的物质的量浓度和其元数的乘积。由于上述关系不清,常常误将pH值求出的氢离子浓度再与酸的元数相乘视为其氢离子浓度。因而得出错误选项C。对于多元强碱也易发生类似错误。
【正解】本题的正确解法为:
pH=10[H+]=1×10-10mol·L-1,[OH-]=1×10-4mol·L-1
pH=12[H+]=1×10-12mol·L-1,[OH-]=1×10-2mol·L-1
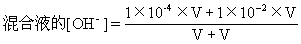
=50.5×10-4mol·L-1
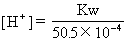
=2×10-12mol·L-1
pH=11.7
本题难度:简单
5、选择题 下列溶液一定呈中性的是?(?)
A.pH=7的溶液
B.c(NH4+)=c(Cl-)的NH4Cl和氨水的混合溶液
C.PH=2的CH3COOH和PH=12的NaOH溶液等体积混合
D.CH3COONa溶液
参考答案:B
本题解析:只要溶液中氢离子浓度大于OH-浓度,溶液就显酸性,小于则显碱性,等于显中性。所以根据电荷是可知,选项B中c(OH—)= c(H+);A无法确定,C显酸性,D显碱性,答案选B。
本题难度:简单