1、选择题 水的电离平衡曲线如图所示,下列说法不正确的是
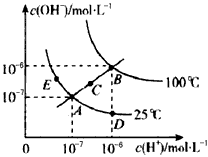
[? ]
A.图中五点Kw间的关系:B>C>A=D=E
B.若从A点到D点,可采用在水中加入少量酸的方法
C.若从A点到C点,可采用温度不变时在水中加入适量NH4Cl同体的方法
D.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
参考答案:C
本题解析:
本题难度:一般
2、填空题 (9分)下表是不同温度下水的离子积常数:
温度/℃
| 25
| t1
| t2
|
水的离子积常数
| 1×10-14
| KW
| 1×10-12
|
试回答以下问题:
(1)若25℃<t1<t2,则KW__________1×10-14(填“>”、“<”或“=”),判断的理由是 。
(2)25℃ 下,将pH=13的氢氧化钠溶液V1 L与pH=1的稀盐酸V2 L混合(设混合后溶液的体积为:V1+V2),所得混合溶液的pH=2,则V1 : V2=__________。
(3)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”、“中性”或“碱性”),溶液中c(Na+) c(CH3COO-)(填“>”、“=”或“<”)。
(4)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 性(填“酸”、 “中”或“碱”),溶液中c(Na+) c(CH3COO-)[填“>”、“=”或“<”] 。
参考答案:(1) > 因为水的电离是吸热反应,温度升高,水的电离程度增大,离子积也增大
(2) 9 : 11 (3)碱性 > (4)酸性 <
本题解析:因为水是弱电解质,若电解质的电离存在电离平衡,升高温度,促进水的电离,所以温度越高,离子积也增大,Kw就越大,所以Kw>1×10-14. (2)25℃ 下, pH=13的氢氧化钠溶液c(OH-)=0.1mol/L;其体积是V1 L与pH=1的稀盐酸,c(H+)=0.1mol/L,其体积是V2 L混合(设混合后溶液的体积为:V1+V2),所得混合溶液的pH=2,混合溶液中c(H+)=0.01mol/L,则(0.1×V2-0.1×V1 )÷(V1+ V2)=0.01;解得V1 : V2=9 : 11。(3)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,恰好产生正盐醋酸钠,但是该盐是强碱弱酸盐,弱酸根离子水解消耗水电离产生的H+,使水的电离平衡正向移动,最终当溶液达到平衡时c(OH-)>c(H+),所以溶液呈碱性;根据溶液呈电中性原则,则溶液中c(Na+)>c(CH3COO-);(4)醋酸是弱酸,部分电离NaOH是强碱完全电离,当pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合时电离产生的离子恰好中和,未电离的醋酸分子会继续电离产生H+。所以混合后溶液呈酸性;根据电荷守恒可得溶液中c(Na+)<c(CH3COO-)。
考点:考查水的离子积常数与温度的关系、酸碱混合溶液的pH的计算、溶液中两种浓度的大小比较的知识。
本题难度:困难
3、选择题 水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是
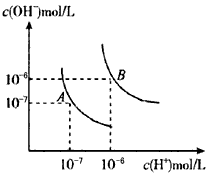
[? ]
A.纯水中25℃时的c(H+)比100℃时的c(H+)大
B.100℃时某溶液中由水电离产生的c(H+)=1×10-11mol/L, 则该溶液的pH可能是11或3
C.将pH=9的Ba(OH)2溶液与pH =4的稀盐酸混合,并保持100℃的恒温,混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为10:1
D.25℃时,某Na2SO4溶液中c(SO42-)=5×10-4mol/L,则溶液中c(Na+):c(OH-)为104:l
参考答案:D
本题解析:
本题难度:一般
4、选择题 下列溶液一定呈酸性的是
A.pH<7的溶液
B.c(H+)>c(OH—) 的溶液
C.pH>7的溶液
D.c(H+)<c(OH—) 的溶液