1、填空题 有A、B、C、D、E?5种元素,它们的核电荷数依次增大,且都小于20.其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1.B和D也属同一族,它们原子最外层的P轨道电子数是s轨道电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半.请回答下列问题:
(1)A是______,B是______,C是______,D是______,E是______.(用元素符号表示)
(2)C、D、E四种元素的简单离子按半径由小到大的顺序为(用离子符号表示)______.
(3)元素B与D的电负性的大小关系是______,C与E的第一电离能的大小关系是______.(填>、<、﹦,用元素符号表示)
(4)用轨道表示式表示D元素原子的外围电子构型______.
(5)写出A和B按原子个数比1:1形成的化合物的电子式______.
(6)用电子式表示D和E形成离子化合物的形成过程______.
参考答案:A、B、C、D、E?5种元素,它们的核电荷数依次增大,A和E属同一族,它们原子的最外层电子排布为ns1,应为第ⅠA族元素,E是金属元素,则A应为H元素,为非金属元素,B和D也属同一族,它们原子最外层的P轨道电子数是s轨道电子数的两倍,价层电子排布为ns2np4,应为第ⅥA族元素,则B为O元素,D为S元素,C原子最外层上电子数等于D原子最外层上电子数的一半,则最外层电子数为3,应为Al元素,则E应为K元素,
(1)由以上分析可知A为H,B为O,C为Al,D为S,E为K,故答案为:H;O;Al;S;K;
(2)Al3+核外有2个电子层,K+、S2-有3个电子层,电子层数越多,半径越大,核外电子排布相同的离子,核电荷数越大,半径越小,则离子半径大小顺序为Al3+<K+<S2-,
故答案为:Al3+<K+<S2-;
(3)同主族元素从上到下元素的电负性逐渐减小,则电负性O>S,同主族元素从上到下元素的第一电离能逐渐减小,同周期从左到右元素的第一电离能逐渐增大,则第一电离能Al>K,故答案为:O>S;Al>K;
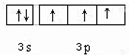
(4)D为S,价层电子排布为3s23p4,用轨道表示式表示D元素原子的外围电子构型为
,故答案为:

;
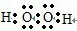
(5)A和B按原子个数比1:1形成的化合物为H2O2,为共价化合物,电子式为
,故答案为:

;
(6)D为S,E为K,电子式表示D和E形成离子化合物的形成过程为
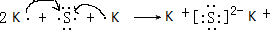
,故答案为:
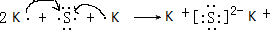
.
本题解析:
本题难度:一般
2、选择题 短周期元素X原子核外的电子处于n个电子层上,最外层电子数为(2n+1),核内质子数为(2n2-1).有关X的说法中不正确的是( )
A.X元素气态氢化物的水溶液呈酸性
B.X能形成化学式为NaXO3的含氧酸钠盐
C.X原子的最外层电子数和核电荷数不可能为偶数
D.X元素常见单质的化学式为X2
参考答案:短周期元素X原子核外的电子处于n个电子层上,最外层电子数为(2n+1),原子核内质子数是2n2-1.假设n=1时,最外层电子数为3,不符合题意;n=2时,最外层电子数为5,质子数为7,符合题意;n=3时,最外层电子数为7,质子数为17,符合题意,
A.X为氮元素或氯元素,氯化氢水溶液呈酸性,但氨气水溶液呈碱性,故A错误;
B.X为氮元素或氯元素,可以形成NaNO3、NaClO3,故B正确;
C.X元素原子最外层电子数为(2n+1),核内质子数为(2n2-1),最外层电子数和核电荷数一定为奇数,不可能为偶数,故C正确;
D.X为氮元素或氯元素,常见单质的化学式为N2、Cl2,故D正确;
故选A.
本题解析:
本题难度:简单
3、选择题 已知元素砷(As)的原子序数为33,下列叙述正确的是( )
A.砷元素的最高化合价为+3
B.砷元素是第五周期的主族元素
C.砷原子的第3电子层含有18个电子
D.砷的氧化物的水溶液呈强碱性
参考答案:砷的原子结构示意图为:
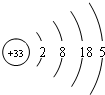
,
A.主族元素的最高化合价与其族序数相同(但O、F除外),所以砷的最高化合价是+5价,故A错误;
B.根据原子结构示意图知,砷位于第四周期,故B错误;
C.根据原子示意图知,砷的第三电子层上有18个电子,故C正确;
D.砷和氮元素处于同一主族,同一主族元素的性质具有相似性,所以砷的氧化物的水溶液呈酸性,故D错误;
故选C.
本题解析:
本题难度:一般
4、填空题 1~18号元素中(除稀有气体元素外),最外层电子数是次外层电子数二倍的元素是______,原子结构示意图______,能与氧形成的氧化物的化学式______、______.①原子半径最大的元素是______,②原子半径最小的元素是______.
参考答案:1~18号元素中(除稀有气体元素外),由最外层电子数是次外层电子数二倍的元素,则次外层电子数为2时,最外层电子数为4,即为C元素,其质子数为6,原子结构示意图为

,碳与氧元素形成CO、CO2氧化物;元素周期表中H原子的半径最小,短周期中由电子层越多,原子半径越大,同周期从左向右原子半径在减小,则Na原子半径最大,
故答案为:C;

;CO;CO2;Na;H.
本题解析:
本题难度:一般
5、选择题 已知1-18号元素的离子aW3+和CY2-具有相同的电子层结构,下列关系正确的是( )
A.质子数c>a
B.离子半径W3+>Y2-
C.W和Y两元素在周期表中位于同一周期
D.原子半径W>Y
参考答案:1-18号元素的离子aW3+和CY2-具有相同的电子层结构,则核外电子数目相同,所以a-3=c+2,W处于Y的下一周期,aW3+和CY2-所带电荷可知,W处于第ⅢA则,Y处于第ⅥA族.
A、aW3+和CY2-具有相同的电子层结构,则核外电子数目相同,所以a-3=c+2,质子数c<a,故A错误;
B、电子层结构相同,核电荷数越大,离子半径越小,质子数c<a,所以离子半径W3+<Y2-,故B错误;
C、W处于Y的下一周期,故C错误;
D、电子层多,半径较大,W处于Y的下一周期,所以原子半径W>Y,故D正确.
故选:D.
本题解析:
本题难度:一般