1、简答题 x、Y、z、w是原子序数依次增大的短周期元素,且互不同族,其中只有两种为金属元素.x原子的最外层电子数与次外层电子数相等,Y原子的最外层电子数与次外层电子数之比为3:1,X与w两原子的最外层电子数之和为9,Z的单质既可与盐酸反应,又能与浓的NaOH溶液反应.据以上信息请回答下列问题.
(1)X的元素符号为:______,W元素在元素周期表中的位置是______w与Y可以按原子个数比1:2形成一种高效安全灭菌消毒剂,其化学式为______
(2)两种非金属元素的气态氢化物中沸点较高是______(用化学式填写).
(3)将Z元素的氧化物投入到一定量盐酸中恰好完全反应,向反应后的溶液中逐滴加入氢氧化钠溶液至过量,现象为______
(4)以海水中含量最大的物质为原料可以生产w的单质,同时还可以得到另外两种重要的工业原料,该反应的化学方程式为______.
参考答案:X原子的最外层电子数与次外层电子数相等,短周期中只有Be和Ar,此处显然X是Be;Y原子的最外层电子数与次外层电子数之比为3:1,则Y有2个电子层,最外层电子数为6,故Y为O元素;X与w两原子的最外层电子数之和为9,则W的最外层电子数为9-2=7,由原子序数可知,W与O元素不可能是同周期,故W为Cl元素;Z的单质既可与盐酸反应,又能与浓的NaOH溶液反应,故Z为Al元素.
(1)由上述分析可知,X为Be元素;W元素是Cl元素,原子有3个电子层,最外层电子数为7,处于元素周期表中第三周期第ⅦA族; W与Y可以按原子个数比l:2形成一种高效安全灭菌消毒剂,该物质化学式为ClO2.
故答案为:Be;第三周期第ⅦA族;ClO2.
(2)两种非金属元素的气态氢化物为H2O、HCl,H2O分子之间存在氢键,H2O沸点较高.
故答案为:H2O.
(3)将Z元素的氧化物氧化铝,将氧化铝投入到一定量盐酸中恰好完全反应,溶液中溶质为氯化铝,向氯化铝溶液中逐滴加入氢氧化钠溶液至过量,首先氯化铝与氢氧化铝反应生成氢氧化铝白色沉淀,当氯化铝反应完毕,再加入氢氧化钠溶液,氢氧化钠与氢氧化铝反应生成偏铝酸钠,白色沉淀减少至最后完全溶解.
故答案为:先生成白色沉淀,白色沉淀增大到最大值后开始减少,最后完全溶解.
(4)电解饱和的食盐水生成氯气,同时生成氢气与氯化钠,反应方程式为2NaCl+2H2O电解.2NaOH+H2↑+Cl2↑.
故答案为:2NaCl+2H2O电解.2NaOH+H2↑+Cl2↑.
本题解析:
本题难度:一般
2、选择题 A?元素的原子最外层电子数是a,次外层电子数是b,B?元素的原子?M?层电子数是(a-b),L?层电子数是(a+b),则?A、B?两种元素形成的化合物的化学式和形成晶体的类型可能为( )
A.B3A2分子晶体
B.BA2原子晶体
C.A3B2离子晶体
D.AB2原子晶体
参考答案:A如果是第三周期的话,次外层电子数b等于8,那么B元素的L层电子数将超过8,矛盾,所以A是第二周期元素,b=2;由B元素L层电子数为a+b,而L层应该是B元素的次外层,所以a=6,这样,A是氧,B是硅,A和B形成的是二氧化硅,属于原子晶体.
故选B.
本题解析:
本题难度:简单
3、选择题 下列说法正确的是( )
A.阴阳离子间通过静电吸引形成的化学键叫做离子键
B.HF,HCl,HBr,HI的热稳定性和酸性均依次减弱
C.同种非金属元素的化合价越高,对应价态含氧酸的酸性和氧化性就越强
D.元素周期律是元素原子核电子排布周期性变化的结果
参考答案:A、阴阳离子间通过静电作用形成的化学键叫做离子键,静电作用包含吸引、排斥等作用,故A错误;
B、同主族自上而下非金属性减弱,HF,HCl,HBr,HI中H-X键减弱,故HF,HCl,HBr,HI的热稳定性减弱,酸性增强,故B错误;
C、同种非金属元素的化合价越高,对应价态含氧酸的酸性越强,氧化性不一定越强,如:氯元素的含氧酸中氯元素化合价越低,氧化性越强,故C错误;
D、因原子结构中核外电子排布的周期性变化而引起元素的性质呈周期性变化,元素的性质呈周期性变化的根本原因是核外电子排布的周期性变化的结果,故D正确;
故选D.
本题解析:
本题难度:一般
4、简答题 X、Y、Z、W是原子序数依次增大的四种短周期元素.X与W可形成正四面体型的共价化合物,Y的次外层电子数等于其最外层和最内层电子数之和的2倍,Y、Z的最外层电子数之和等于W的最外层电子数.回答下列问题:
(1)用化学符号表示X的一种核素______.
(2)写出Y的单质与X的最高价氧化物反应的化学方程式______.
(3)Z的单质在W的单质中燃烧,生成的产物中各原子的最外层均达到8电子稳定结构的分子属于______(填“极性分子”或“非极性分子”).
(4)Y与W形成的化合物的电子式为______.
(5)与Z同主族的元素M可与X形成一种化合物,该化合物是新近人工合成的比金刚石硬度大的无机非金属材料,其化学式为______.
(6)W的氢化物R是实验室一种常用试剂的主要成分,该试剂可用于实验室多种气体的制备,写出实验室制取气体时满足下列条件的离子方程式.
①R作氧化剂:______.
②R作还原剂:______.
参考答案:X、Y、Z、W是原子序数依次增大的四种短周期元素.Y的次外层电子数等于其最外层和最内层电子数之和的2倍,则Y有3个电子层,令最外层电子数为a,则(a+2)×2=8,解得a=2,故Y为镁元素;X与W可形成正四面体型的共价化合物,则为第ⅣA族与ⅦA族元素,若X为第ⅣA族元素,W为第ⅦA族元素,原子序数X小于镁元素,则X为碳元素,W为氯元素,Y、Z的最外层电子数之和等于W的最外层电子数,Z的最外层电子数为7-2=5,原子序数Z大于镁元素,Z为磷元素,符合题意.若X为第ⅦA族元素,W为第ⅣA族元素,原子序数X小于镁元素、W大于X,X为氟元素,W为硅元素,Y、Z的最外层电子数之和等于W的最外层电子数,Z的最外层电子数为4-2=2,原子序数Z大于镁元素,不符合题意.故X为碳元素,Y为镁元素,Z为磷元素,W为氯元素.
(1)X为碳元素,X的核素很多,有612C、613C、614C.
故答案为:612C或613C或614C.
(2)Y为镁元素,X为碳元素,X的最高价氧化物为二氧化碳,镁在二氧化碳中燃烧生成氧化镁与碳,反应的化学方程式 2Mg+CO2?点燃?.?2MgO+C.
故答案为:2Mg+CO2?点燃?.?2MgO+C.
(3)Z为磷元素,W为氯元素,磷在氯气中燃烧,生成的产物中各原子的最外层均达到8电子稳定结构,该化合物为PCl3,P原子采取sp3杂化,且含有1对孤对电子,为三角锥型,分子不对称,属于极性分子.
故答案为:极性分子.
(4)Y为镁元素,W为氯元素,二者形成的化合物是氯化镁,属于离子化合物,由镁离子与氯离子构成,电子式为
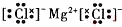
.
故答案为:
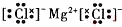
.
(5)X为碳元素,Z为磷元素,与Z同主族的元素M可与X形成一种化合物,该化合物是新近人工合成的比金刚石硬度大的无机非金属材料,该化合物化学式为C3N4.
(6)W为氯元素,W的氢化物R是HCl.
①HCl作氧化剂,符合条件离子方程式为2H++Zn═Zn2++H2↑.
故答案为:2H++Zn═Zn2++H2↑.
②HCl作还原剂,符合条件离子方程式为MnO2+4H++2Cl-??△?.?Mn2++Cl2↑+2H2O.
故答案为:MnO2+4H++2Cl-??△?.?Mn2++Cl2↑+2H2O.
本题解析:
本题难度:一般
5、填空题 A、B、C、D、E是短周期元素,周期表中A与B、B与C相邻,且C与E同主族;A与E的最外层电子数之比2:3,B的最外层电子数比C的最外层电子数少1个;常见化合物D2C2与水反应生成C的单质,且溶液使酚酞试液变红.
(1)E的元素名称是______.该元素在周期表中的位置为______
(2)A、B、C的氢化物稳定性由弱到强的顺序为(用分子式表示)______;B的氢化物和B的最高价氧化物的水化物反应生成Z,则Z中所含化学键的类型为______
(3)写出D2C2的电子式______.用电子式表示只含D、E两种元素的化合物的形成过程______
(4)写出D2C2与H2O反应的离子方程式______.
参考答案:根据常见化合物D2C2与水反应生成C的单质,且溶液使酚酞试液变红,可知C为O元素,D为Na元素,B的最外层电子数比C的最外层电子数少1个,则B的最外层电子数为5,且相邻,应为N元素,C与E同主族,E应为S元素,A与B相邻,A与E的最外层电子数之比2:3,则A的最外层电子数为4,应为C元素.
(1)E为S元素,原子序数为16,核外有3个电子层,最外层电子数为6,位于周期表第三周期VIA族,
故答案为:硫;第三周期VIA族;
(2)A、B、C分别为C、N、O元素,同一周期元素从左到右元素的非金属性逐渐增强,对应的氢化物的稳定性逐渐增大,A、B、C的氢化物稳定性由弱到强的顺序为CH4<NH3<H2O,B的氢化物和B的最高价氧化物的水化物反应生成Z,则Z为NH4NO3,为离子化合物,含有离子键、极性键,故答案为:CH4<NH3<H2O;离子键、极性键;
(3)Na2O2为离子化合物,电子式为
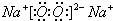
,D和E形成的化合物为Na2S,为离子化合物,用电子式表示的形成过程为
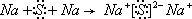
,故答案为:
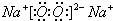
;
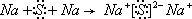
;
(4)Na2O2与水反应生成NaOH和氧气,反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑.
本题解析:
本题难度:一般