1、选择题 将标准状况下的2.24 L CO2通入150 mL 1mol / LNaOH溶液中,下列说法正确的是
A.c(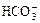 )略大于c(
)略大于c( )
)
B.该溶液只能与酸反应,不能与碱反应
C.c(Na+)等于c( )与c(
)与c(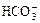 )之和
)之和
D.c(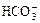 )略小于c(
)略小于c( )
)
参考答案:A
本题解析:略
本题难度:一般
2、选择题 实验室需配置一种符合下列条件的溶液:①无色且仅含四种离子(不包括水电离出的离子);②混合溶液中四种离子的物质的量浓度均为1mol/L。下列符合该条件的是
A. NH+ 4 Na+ NO- 3 Cl-
B. Fe2+ K+ HS- ClO-
C. Ca2+ K+ SO2- 3 CH3COO-
D. K+ Na+ Cl- SO2- 4
参考答案:A
本题解析:A 符合,四种离子均无色,且物质的量浓度均为1mol/L,溶液中正、负电荷的数目相等。
B 不符合,Fe2+为浅绿色
C 不符合,Ca2+、SO2- 3会产生沉淀
D 不符合,四种离子的物质的量浓度均为1mol/L,溶液会带负电。
本题难度:简单
3、选择题 等体积、等物质的量浓度的NaCl和NaF溶液中,阴阳离子总数相比?(?)
A.前者多
B.后者多
C.一样多
D.无法判断
参考答案:B
本题解析:
正确答案:B
NaF是强碱弱酸盐,F++H2O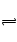 HF+OH― ,促进水电离。后者生成的OH―多,阴阳离子总数相比后者多。
HF+OH― ,促进水电离。后者生成的OH―多,阴阳离子总数相比后者多。
本题难度:简单
4、选择题 下列有关判断正确的是( )
A.0.1 mol·L-1Na2SO3溶液中有c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3)
B.0.1 mol·L-1NH4Fe(SO4)2溶液中离子浓度大小关系为c(SO42-)>c(Fe3+)=c(NH4+)>c(H+)>c(OH-)
C.0.2 mol·L-1Na2CO3溶液与0.1 mol·L-1NaHCO3溶液等体积混合后有c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
D.0.2 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合得到的溶液一定呈酸性
参考答案:C
本题解析:SO32-发生水解,则由物料守恒可得c(Na+)
=2c(SO32-)+2c(HSO3-)+2c(H2SO3),A错误;NH4Fe(SO4)2溶液中,Fe3+、NH4+的水解能力不同,故c(NH4+)不等于c(Fe3+),B错误;依据电荷守恒可知C正确;题给两种溶液混合后得到等浓度的NaA和HA溶液,若HA的电离程度小于A-的水解程度,则溶液呈碱性,D错误。
本题难度:一般
5、选择题 下列溶液中微粒浓度关系不正确的是(?)
A.常温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)=c(NH4+)
B.pH=1的一元酸和pH=13的一元碱等体积混合:c(OH-)=c(H+)
C.0.1 mol·L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
D.0.1 mol·L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S)
参考答案:AC
本题解析:氨水与氯化铵的混合溶液中存在电荷守恒:c(NH4+)+c(H+)=c(OH-)+c(Cl-),常温下溶液pH=7,即c(H+)=c(OH-),所以c(NH4+)=c(Cl-),A项正确;选项B,没有指明酸、碱的强弱,故不能判断溶液的酸碱性,B项错;(NH4)2SO4中NH4+的水解是微弱的(水解显酸性),故0.1 mol·L-1的(NH4)2SO4溶液中:0.1 mol·L-1<c(NH4+)<0.2 mol·L-1,则有c(NH4+)>c(SO42-)>c(H+)>c(OH-),C项正确;硫化钠溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),存在物料守恒:c(Na+)=2[c(HS-)+c(S2-)+c(H2S)],由两式联立可得c(OH-)=c(HS-)+2c(H2S)+c(H+),D项错。
本题难度:一般