1、选择题 VCD光盘上的记录材料有多种,它们可在激光照射下发生化学或记忆性能的改变而记录、储存信号.碲的某化合物就是常用的VCD光盘记录材料之一,对碲及其化合物的以下认识中不正确的是( )
A.单质碲在常温下是固体
B.H2TeO4的酸性比H2SO4的酸性弱
C.H2Te不如HI稳定
D.Te元素位于第六周期ⅥA族
参考答案:A.ⅥA族的单质中只有O元素的单质为气体,且随原子序数的增大,由气态变为固态,则单质碲在常温下是固体,故A正确;
B.非金属性S>Te,则H2TeO4的酸性比H2SO4的酸性弱,故B正确;
C.Fe、I位于同周期,原子序数大的非金属性强,非金属性Te<I,则H2Te不如HI稳定,故C正确;
D.Te的原子结构中各层电子分别为2、8、18、18、6,Te元素位于第五周期ⅥA族,故D错误;
故选D.
本题解析:
本题难度:简单
2、填空题 A、B、C、D、E、F都是短周期元素,原子序数依次增大。

(1)D2C的电子式________________;
(2)沸点:A2C________A2E(填“>”或“<”或“=”)。
(3)E的非金属性比F_________(填“强”或“弱”),并用化学事实加以说明(用化学方程式表示)
__________________________
(4)化合物甲由A、B、C、D四种元素组成,其化学式量为84,是焙制糕点所用发酵粉的主要成分之一。写出甲在水溶液中与盐酸反应的离子方程式________________________
参考答案:(1)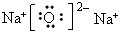
(2)>
(3)弱;H2S+Cl2==S↓+2HCl(或2Fe+3Cl2==2FeCl3、Fe+S==FeS)
(4)HCO3-+H+==CO2↑+H2O
本题解析:
本题难度:一般
3、选择题 对于VIIA族元素,下列说法正确的是( )
A.可形成-2价离子
B.从上到下原子半径逐渐减小
C.从上到下原子半径逐渐增大
D.从上到下非金属性逐渐增强
参考答案:A.因最外层电子数为7,可形成-1价离子,故A错误;
B.从上到下,原子序数在增大,原子半径在增大,故B错误;
C.从上到下,原子序数在增大,原子半径在增大,故C正确;
D.从上到下,原子序数在增大,得电子能力减弱,则非金属性逐渐减弱,故D错误;
故选C.
本题解析:
本题难度:简单
4、选择题 在元素周期表的金属和非金属的分界线的附近可以找到
[? ]
A.半导体材料
B.人畜安全的高效农药
C.催化剂
D.氟利昂的代用品
参考答案:A
本题解析:
本题难度:简单
5、填空题 如表是元素周期表的一部分,其中所列字母分别代表某一元素.请你根据表中所给元素,回答下列问题:
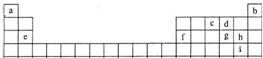
(1)“大爆炸理论”指出:200亿年以前,宇宙中所有物质都包含在一个密度无限大,温度无限高的原始核中,由于某种原因它发生了爆炸,首先产生了中子、质子和电子,随后就产生了元素.你由此可知最先产生的元素是______(填写表中字母).
(2)e、f单质及ef合金中硬度最大的是______(填写名称).
(3)请写出原子核外最外层电子数为最内层电子数3倍的元素原子的核外电子排布式:______,该元素低价氧化物在一定条件下转化为高价氧化物的反应为工业重要反应,请写出此反应的化学方程式______.
(4)比较表中cdg三种元素的第一电离能的大小顺序______.
(5)请写出能验证h和i非金属性强弱的一个化学反应的离子方程式______.
(6)用来组成酸、碱、盐三类物质至少需要的元素有______(填写表中字母).
参考答案:(1)构成最简单的原子也就是最容易构成的原子,最简单的原子是氢原子.
故答案为:a.
(2)合金的硬度大于合金中任一金属的硬度,所以e、f单质及ef合金中硬度最大的是镁铝合金.
故答案为:镁铝合金.
(3)如果最外层是第二电子层,原子核外最外层电子数为最内层电子数3倍的元素原子是O原子,但不符合题意;如果最外层是第三电子层,该原子是S,符合题意;其核外电子排布式为:1s22s22p63s23p4.
该元素低价氧化物为二氧化硫,二氧化硫和氧气能发生氧化还原反应生成三氧化硫,
反应方程式为:2SO2+O2催化剂.△2SO3.
故答案为:1s22s22p63s23p4;2SO2+O2催化剂.△2SO3.
(4)同一周期,元素的第一电离能随着原子序数的增大而增大,但第ⅡA族的第一电离能大于第ⅢA族,第ⅤA族的第一电离能大于第ⅥA族的;同一主族,第一电离能随着原子序数的增大而减小,N、O元素属于同一周期,N元素属于第ⅤA族,O元素属于第ⅥA族,所以氮元素的第一电离能大于氧元素的;O、S元素属于同一主族,且硫元素的原子序数大于氧元素的,所以氧元素的第一电离能大于硫元素的,所以cdg三种元素的第一电离能的大小顺序为c>d>g(或N>O>S).
故答案为:c>d>g(或N>O>S).
(5)h和i属于同一主族,元素的非金属性越强,其氧化性越强,只要氯气能置换溴单质即可证明氯元素的非金属性强于溴元素的,离子反应方程式为:Cl2+2Br-=2Cl-+Br2.
故答案为:Cl2+2Br-=2Cl-+Br2.
(6)酸的组成中必有氢元素,碱中必有氢氧,盐中有酸根阴离子和金属阳离子或铵根离子,酸中必须至少还有一种元素,若盐中含有金属阳离子,这样至少含有4种元素;若盐中含有铵根离子,酸根离子为硝酸根离子,这样至少含有3种元素,所以用来组成酸、碱、盐三类物质至少需要的元素有三种,即acd.
故答案为:acd.
本题解析:
本题难度:一般