1、选择题 下列反应中不属于氧化还原反应的是
A.NO+NO2+2NaOH==2NaNO3+H2O
B.NH3+HCl== NH4Cl
C.Br2+2KI==I2+2KBr
D.2H2O2==2H2O+O2↑
参考答案:B
本题解析:氧化还原反应的实质是原子获得(或偏向)电子的过程,表现为元素的化合价的升高(或降低)。标出各元素的化合价,可知A选项的N,C选项的Br和I,D选项的O的化合价反应前后发生变化,故只有B不属于氧化还原反应。
点评:氧化还原反应是高考的必考内容,考生应把握以下两点:一、判断一个反应是否属于氧化还原反应,以及氧化剂(产物)、还原剂(产物)分别是什么;二、利用得失电子配平所给化学反应,并能进行简单的有关于电子守恒的计算。
本题难度:简单
2、选择题 相等物质的量的KClO3分别发生下述反应:①有MnO2催化剂存在时,受热分解得到氧气; ②若不使用催化剂,加热至470?℃左右,得到KClO4(高氯酸钾)和KCl。下列关于①和②的说法不正确的是
A.都是氧化还原反应
B.发生还原反应的元素相同
C.发生氧化反应的元素不同
D.生成KCl的物质的量相同
参考答案:D
本题解析:
本题难度:简单
3、填空题 (1)下列反应中是离子反应的写出离子方程式,否则写化学反应方程式;是氧化还原反应的,用双线桥标出电子转移的方向和数目
①盐酸与碳酸钙的反应__________________________________
②铜加入硝酸银溶液中_____________________________________
(2)2molO3和3molO2的质量 ? (填相等、不相等或无法判断);分子数之比为? ;含有氧原子的数目之比为? ;在相同条件下气体的体积比为? 。
参考答案:
(1)① CaCO3+2H+=H2O+CO2↑+ Ca2+?
? ② 
(2)相等;2︰3;1︰1;2︰3
本题解析:
本题难度:一般
4、选择题 在Cu2S+2Cu2O===6Cu+SO2↑反应中,说法正确的是( )
A.生成1 mol Cu,转移2 mol电子
B.Cu是氧化产物
C.氧化剂只有Cu2O
D.Cu2S既是氧化剂,又是还原剂
参考答案:D
本题解析:A 错误,生成1 mol Cu,转移21mol电子
B.错误,Cu是还原产物
C 错误,氧化剂有Cu2O? Cu2S
D 正确?铜的化合价降低,是氧化剂,硫的化合价升高,是还原剂,所以,Cu2S既是氧化剂,又是还原剂
本题难度:一般
5、填空题 (12分)过量铁粉与稀硝酸反应的方程式为:
3Fe + 8HNO3 (稀)="=" 3Fe(NO3)?2 + 2NO↑ + 4H2O,
①标出电子转移的方向和数目
②该反应的氧化剂是?,还原产物是?;
③标准状况下,当生成2.24L NO气体时, 有??g Fe参加反应,转移电子的物质的量为?,有?mol氧化剂被还原。
参考答案:(12分)
.①
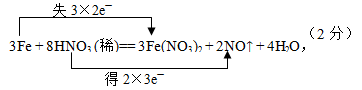 (2分)
(2分)
② HNO3,NO(各2分)?③8.4,0.3mol,0.1 (各2分)
本题解析:(1)从反应方程观察,Fe变成Fe2+,失去电子总数为3×2e-,硝酸中的N元素由+5价被还原成+2价,从产物上观察,8mol硝酸只有2mol硝酸得到电子被还原,所以得电子总数为2×3e-。
(2)反应中得电子的物质是氧化剂,氧化剂得电子后生成的物质称为还原产物,所以该反应的氧化剂是 HNO3,还原产物为NO。
(3)生成2.24L NO说明HNO3 得到0.3mole-,转移电子数也就是0.3mol,而唯一提供电子的还原剂Fe要提供0.3mol电子,需要0.15molFe,质量为0.15mol×56g/mol=8.4g,最后根据N元素守恒,还原产物NO中的N元素物质的量应该等于被还原的硝酸的物质的量,所以有0.1mol氧化剂被还原.
本题难度:一般