1、填空题 下列物质?①Cu?②液态SO2?③纯醋酸?④NaHCO3?⑤Ba(OH)2溶液
I.属于非电解质的是______;(填序号)
Ⅱ.(1)NaHCO3是一种______(填“强”或“弱”)电解质;
(2)写出HCO3-水解的离子方程式:______;
(3)常温下,0.1mol-L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3-、H2CO3、CO32-、OH?-五种微粒的浓度由大到小的顺序为:______.
Ⅲ.Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液.
(1)该Ba(OH)2溶液的物质的量浓度为______;
(2)溶液中由水电离出c(OH?-)=______;
(3)与某浓度盐酸溶液按体积比(碱与酸之比)1:9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=______.
Ⅳ.醋酸是一种弱电解质.?某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如右图所示.则图______(填“I”或“Ⅱ”)为醋酸稀释的图象.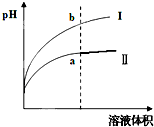
参考答案:Ⅰ、①Cu是金属单质能导电,但单质即不是电解质也不是非电解质;
②液态SO2是共价化合物不能导电,不是电解质,属于非电解质;
③纯醋酸溶于水能导电,是电解质;
④NaHCO3是离子化合物,是电解质;
⑤Ba(OH)2溶液是混合物,即不是电解质也不是非电解质.
故选:②;
Ⅱ、(1)NaHCO3属于盐,在水溶液中完全电离,属于强电解质,故答案为:强;
(2)HCO3-水解生成碳酸与氢氧根离子,水解离子方程式为HCO3-+H2O
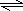
H2CO3+OH-,故答案为:HCO3-+H2O
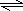
H2CO3+OH-;
(3)常温下,0.1mol?L-1NaHCO3溶液的pH大于8,c(OH-)>c(H+),说明HCO3-水解程度大于其电离程度,故c(Na+)>c(HCO3-)、c(H2CO3)>c(CO32-),水解程度不大所以c(HCO3-)>c(H2CO3)、c(HCO3-)>c(OH-),溶液中氢氧根来源于水的电离与HCO3-水解,故c(OH-)>c(H2CO3),所以c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-),
故答案为:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-);
Ⅲ、(1)pH=13的Ba(OH)2溶液中c(OH-)=0.1mol/L,根据氢氧根守恒可知,溶液中c[Ba(OH)2]=12c(OH-)=0.5×0.1mol/L=0.05mol/L,故答案为:0.05mol/L;
(2)pH=13的Ba(OH)2溶液中氢离子使由水电离产生的,水电离产生的c(H+)等于溶液中水电离出c(OH?-),故水电离出c(OH?-)=c(H+)=10-13mol/L,
故答案为:10-13mol/L;
(3)pH=13的Ba(OH)2溶液中c(OH-)=0.1mol/L,与某浓度盐酸溶液按体积比(碱与酸之比)1:9混合后,假定体积分别为1L、9L,所得溶液pH=11,即混合后溶液中c(OH?-)=10-3mol/L,令盐酸的浓度为amol/L,则混合后溶液中n(OH?-)=1L×0.1mol/L-9L×amol/L=10-3mol/L×(1L+9L),解得a=0.01,
故答案为:0.01mol/L;
Ⅳ、盐酸是强电解质,醋酸是弱电解质,相同pH值的盐酸和醋酸溶液分别加水稀释,醋酸稀释促进醋酸电离继续产生氢离子,故稀释相同的倍数,醋酸的PH增大的较小,故图Ⅱ为醋酸稀释的图象,故答案为:Ⅱ.
本题解析:
本题难度:一般
2、选择题 向NaOH(aq)滴入HAc(aq)的过程中,溶液中离子浓度的大小可能正确的是
A.c(OH-) = c(Na+) > c(Ac-) > c(H+)
B.c(Na+) > c(OH-) = c(Ac-) > c(H+)
C.c(Na+) > c(Ac-) > c(OH-) > c(H+)
D.c(H+) > c(Ac-) > c(Na+) > c(OH-)