1、选择题 NA表示阿伏加德罗常数,下列说法中正确的是( )
A.标准状况下,22.4 L H2中所含电子数为2NA
B.1 mol CO2与1 L 2 mol·L-1的NaOH溶液反应后,溶液中CO32-数为NA
C.6.8 g熔融的KHSO4中含有0.1NA个阳离子
D.3.36 L氯气与2.7 g铝充分反应,转移电子数一定为0.3NA
2、选择题 下表为4种常见溶液中溶质的质量分数和物质的量浓度.这4种溶液中密度最大的是
?
|
A.HCl
B.NaOH
C.CH3COOH
D.HNO3
|
溶质溶质的质量分数/%
| 36.5
| 40
| 60
| 63
|
物质的量浓度/mol·L?1
| 11.8
| 14.3
| 10.6
| 13.8
3、实验题 实验室中有一未知浓度的稀盐酸,某同学测定盐酸的浓度在实验室中进行实验。请完成下列填空:
(1)配制100 mL 0.10 mol·L-1NaOH标准溶液。
①主要操作步骤:计算→称量→溶解→(冷却后)→洗涤(并将洗涤液移入容量瓶)→__________→__________→__________→将配制好的溶液倒入试剂瓶中,贴上标签。
②称量__________g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、__________、__________。
(2)取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
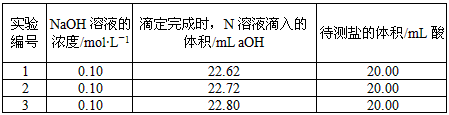
①滴定达到终点的标志是__________________。
②根据上述数据,可计算出该盐酸的浓度约为__________(保留两位有效数字)。
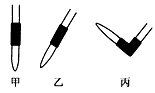
③排去碱式滴定管中气泡的方法应采用如图所示操作中的__________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有__________。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸、润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
4、选择题 溶液的配制过程能引起浓度偏高的是
①用1g98%的浓硫酸加4g水配成1:4(体积比)的硫酸.
②配制一定物质的量浓度的硫酸溶液时,定容后,塞好塞子倒转摇匀后,发现液面低于刻度线.
③10%的硫酸和90%的硫酸等体积混合配制50%的硫酸溶液.
④在80mL水中加入18.4mol/L的硫酸20mL,配制3.68mol/L的硫酸溶液.
⑤质量分数为5x%和x%的两种氨水等体积混合配成3x%的氨水.( )
A.①③⑤
B.②④⑤
C.③④
D.④⑤
5、选择题 相同质量的SO2和SO3,它们之间的关系正确的是(?)
A.所含硫原子的物质的量之比为1:1
B.所含氧原子的物质的量之比为3:2
C.氧元素的质量比为5: 6
D.硫元素的质量比为5:4
|