1、实验题 (6分)(1)用18.0 mol/L H2SO4配制100 mL 1.00mol/L H2SO4,则需要的实验仪器除了烧杯、玻璃棒、胶头滴管以外还应该有:______
配制过程中,下列情况会使配制结果偏高的是(填序号)____?
①定容是俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度
④容量瓶盛过H2SO4溶液,使用前未洗涤
(2)在容量瓶使用方法中,下列操作不正确的是(填字母)_________
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C .配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2㎝处,再改用胶头滴管加蒸馏水到刻度线
.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2㎝处,再改用胶头滴管加蒸馏水到刻度线
D.盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转摇匀
2、实验题 下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4?500ml的操作,请按要求填空:?
(1)所需浓H2SO4的体积为____________ml
(2)如果实验室有15mL、20mL、50mL量筒,应选用_________?mL量筒最好。量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将________(偏高、偏低、无影响)。?
(3)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL水的?________里,并不断搅拌,目的是__________。?
(4)将_________的上述溶液沿________注入________中,并用50mL蒸馏水洗涤烧杯2~3次,洗涤液要_________中,并摇匀。?
3、选择题 把VL含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含amol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为
[? ]
A.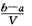 mol·L-1
mol·L-1
B.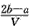 mol·L-1
mol·L-1
C.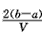 mol·L-1
mol·L-1
D.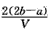 mol·L-1
mol·L-1
4、选择题 下列说法正确的是( )
A.物质的量可理解为物质的质量
B.物质的量是表示物质所含粒子多少的一个物理量
C.物质的量就是物质的粒子数目
D.物质的量的单位--摩尔只适用于原子、分子和离子
5、选择题 跟100mL?0.1mol?L-1(NH4)2SO4溶液中的NH4+浓度相同的是( )
A.0.1mol?L-1NH4NO3溶液100mL
B.0.2mol?L-1氨水溶液100mL
C.0.2mol?L-1NH4Cl溶液200mL
D.0.2mol?L-1(NH4)2SO4溶液50mL