1、填空题 接触法制硫酸的核心反应是2SO2(g)+O2(g)?2SO3(g)△H<0.
(1)该反应的平衡常数K值的表达式:K=______;升高温度,K值将______(填“增大”、“减小”、“不变”)
(2)生产中用过量的空气能使SO2的转化率______(填“增大”、“减小”、“不变”),该反应为何在常压下进行______.
参考答案:(1)K=C2(SO3)C2(SO2).C(O2),该反应是放热反应,升高温度,平衡向逆反应方向移动,生成物浓度减小,反应物浓度增大,所以K减小;
故答案为:C2(SO3)C2(SO2).C(O2),减小;
(2)生产中用过量的空气,使平衡向正反应方向移动,从而能使SO2的转化率增大,该反应是一个反应前后气体体积减小的反应,增大压强有利于平衡向正反应方向移动,但在400~500℃、常压和催化剂的作用下,二氧化硫的转化率就达到90%,增大压强对设备的要求更高,且对转化率的提高不大,所以选常压条件;
故答案为:增大,在400~500℃、常压和催化剂的作用下,二氧化硫的转化率就达到90%,增大压强对设备的要求更高,且对转化率的提高不大.
本题解析:
本题难度:一般
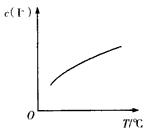
2、选择题 固体碘微溶于水,实验室配制较浓“碘水”时常将固体碘溶于一定浓度的KI溶液中。已知:I2与KI溶液发生如下反应:I2(aq) +I-(aq) I3-(aq),达到平衡后,溶液中I-的平衡浓度c(I-)随温度T的变化如图所示。下列有关说法正确的是
I3-(aq),达到平衡后,溶液中I-的平衡浓度c(I-)随温度T的变化如图所示。下列有关说法正确的是
[? ]
A.反应I2(aq) +I-(aq) I3-(aq)的△H>0
I3-(aq)的△H>0
B.该反应的平衡常数随温度的升高而减小
C.向I2的KI水溶液中加入CCl4或H2O2均可使溶液中的c(I-)增大
D.依此原理,Cl2在NaCl溶液中溶解度增大
参考答案:B
本题解析:
本题难度:一般
3、选择题 已知反应2SO2(g)+O2(g) 2SO3(g)ΔH<0,向某体积恒定的密闭容器中按体积比2∶1充入
2SO3(g)ΔH<0,向某体积恒定的密闭容器中按体积比2∶1充入
SO2和O2,在一定条件下发生反应。下图是某物理量(Y)随时间(t)变化的示意图(图中T表示温度),Y可以是
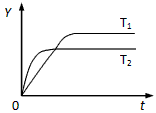
[? ]
A.O2的体积分数
B.混合气体的密度
C.密闭容器内的压强
D.SO2的转化率
参考答案:D
本题解析:
本题难度:一般
4、选择题 反应aM(g)+bN(g)?cP(g)+dQ(g)达到平衡时.M的体积分数y(M)与反应条件的关系如图所示.其中Z表示反应开始时N的物质的量与M的物质的量之比.下列说法正确的是( )
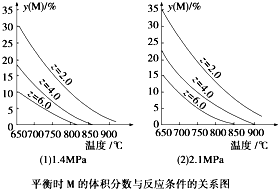
A.同温同压Z时,加入催化剂,平衡时Q的体积分数增加
B.同压同Z时,升高温度,平衡时Q的体积分数增加
C.同温同Z时,增加压强,平衡时Q的体积分数增加
D.同温同压时,增加Z,平衡时Q的体积分数增加
参考答案:A、催化剂同程度影响正、逆化学反应速率,对平衡移动无影响,同温同压同Z时,加入催化剂,平衡时Q的体积分数不变,故A错误;
B、对比(1)(2)两个图象,温度升高,M的体积分数减小,说明正反应为吸热反应,同压同Z时,升高温度,平衡向正反应方向移动,则平衡时Q的体积分数增加,故B正确
C、同温同Z时,增加压强,M的体积分数增大,说明a+b<c+d,平衡向逆反应方向移动,则Q的体积分数减小,故C错误;
D、由图象可知,Z值越大,M的体积分数越小,有利于M的转化率的提高,但Q的体积分数不一定增大,如加入N的物质的量较多,虽然有利于平衡右移,但Q的体积分数依然较小,故D错误;
故选B.
本题解析:
本题难度:简单
5、选择题 已知,H2(g) +I2(g)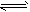 2HI(g) △H<0有相同容积的定容密封容器甲和乙,甲中加入H2和I2各
2HI(g) △H<0有相同容积的定容密封容器甲和乙,甲中加入H2和I2各
0.1mol,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
[? ]
A.甲、乙提高相同温度
B.甲中加入0.1molHe,乙不改变
C.甲降低温度,乙不变
D.甲增加0.1molH2,乙增加0.1molI2
参考答案:C
本题解析:
本题难度:一般