1、填空题 【化学—选修3:物质结构和性质】(15分)
元素周期表是研究元素原子结构及性质的重要工具。现有X、Y和Z三种元素,其原子序数依次减小。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子,X跟Y可形成化合物X2Y3。Z元素既可以形成正一价离子也可形成负一价离子。请回答下列问题:
(1)Y元素原子的价层电子的轨道表示式为______________,该元素的名称是_____;
(2)在X与Z形成的化合物XZ3中,X的杂化类型是?,该化合物的空间构型为_____________;短周期元素形成的化合物中与XZ3互为等电子体的是 ??;
(3)请写出X的两种含氧酸的化学式?、?,其中酸性较强的是?。
(4)Q与Z同主族。Q单质的晶胞如下图所示,若设该晶胞的密度为ag/cm3,阿伏加德罗常数为NA,Q原子的摩尔质量为M,则表示Q原子半径的计算式为 ?。

参考答案:(15分)
(1) 或
或 ?(2分)?氧。(1分)
?(2分)?氧。(1分)
(2)sp3(2分),三角锥形。(1分)NH3、PH3(2分,每个1分)
(3)H3AsO3、H3AsO4。(共2分,各1分)H3AsO4(1分)
(4)  ?(4分,只要有这个式子即给4分,有无单位或对错均不考虑。)
?(4分,只要有这个式子即给4分,有无单位或对错均不考虑。)
本题解析:X元素原子的4p轨道上有3个未成对电子,所以X是第四周期第五主族元素As元素;Y元素原子的最外层2p轨道上有2个未成对电子,则2p上的电子可能是2个也可能是4个,所以Y元素可能是C或O;X跟Y可形成化合物X2Y3,说明Y的化合价为-2价,所以Y是O元素;Z元素既可以形成正一价离子也可形成负一价离子,则Z是H元素。
(1)Y元素原子最外层6个电子,所以价电子的轨道表示式为 ;该元素是O;
;该元素是O;
(2)在X与Z形成的化合物XZ3中,即AsH3,As的价层电子对数=3+1/2(5-3)=4,所以As是sp3杂化;空间构型为三角锥型;短周期元素形成的化合物中与XZ3互为等电子体的是同主族元素的氢化物NH3、PH3;
(3)As的两种含氧酸的化学式为H3AsO3、H3AsO4。根据酸性强弱的判断依据,同种元素的化合价越高,其含氧酸的酸性越强,所以H3AsO4的酸性强;
(4)由图可知,该晶胞中Q原子的个数是8×1/8+1=2,设晶胞的棱长为xcm,原子半径为rcm,则4r=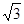 x,根据已知得a=2M/NAx3,可计算出x,所以r=
x,根据已知得a=2M/NAx3,可计算出x,所以r=
本题难度:一般
2、填空题 (15分)A、B、C、D、E、F、G是核电荷数依次增大的短周期主族元素。元素A的原子半径是所有元素中最小的。A、D同主族,B、C同周期,C、F最外层电子数相等,F的质量数为C的2倍,元素B的一种常见单质可做惰性电极材料,其最高价氧化物甲为常见温室气体。B、C、F的质子数之和等于E、G的质子数之和。
(1)由A、B、C、D四种元素组成的一种常见化合物乙是__________________(填写化学式);(2分)
(2)由C、D、E三种元素组成的一种化合物丙是____________(填写化学式);(2分)
(3)G单质与水反应的离子方程式为_________________________________________;(3分)
(4)书写甲的电子式____________________________(2分)
(5)A2C和A2F中,沸点较高的是??(填化学式)(1分),
液态A2C汽化需要破坏微粒间的作用是______________________(2分)
(6)少量甲通入丙溶液中的离子方程式是__________________________________;(3分)
参考答案:(1)NaHCO3(2分)? (2)NaAlO2(2分)? (3)Cl2+H2O H++Cl—+HClO(3分)
H++Cl—+HClO(3分)
(4) (2分)?(5)H2O(1分),氢键(2分)
(2分)?(5)H2O(1分),氢键(2分)
(6)CO2+2AlO2—+3H2O==2Al(OH)3↓+CO32—(3分)
本题解析:考查元素周期表的结构。根据元素的结构、位置及有关性质可知,A、B、C、D、E、F、G分别是H、C、O、Na、Al、S、Cl。
(1)由H、C、O、Na四种元素组成的一种常见化合物乙是NaHCO3。
(2)由O、Na、Al三种元素组成的一种化合物丙是NaAlO2。
(3)氯气溶于水生成盐酸和次氯酸,方程式为Cl2+H2O H++Cl—+HClO。
H++Cl—+HClO。
(4)甲是CO2,含有极性键,电子式为 。
。
(5)由于水分子间存在氢键,所以水的沸点高于硫化氢的。水汽化是物理变化,需要破坏氢键。
(6)CO2和偏铝酸钠反应生成氢氧化铝沉淀,CO2不足,所以生成的是碳酸钠,方程式为CO2+2AlO2—+3H2O==2Al(OH)3↓+CO32—。
本题难度:一般
3、填空题 (15分)在周期表主族元素中,甲元素与乙、丙、丁三元素上下或左右紧密相邻。甲、乙两元素的原子序数之和等于丙元素的原子序数。这四种元素的最外层电子数之和为20。据此可以推断:
(1)元素甲为_______________,元素丙为_______________。
(2)元素乙和丁所形成化合物的化学式为_______________或_______________。
(3)四元素所形成的化合物相对分子质量最大的是_______________(写化学式),其分子内电子数为__________,它与水反应的化学方程式为__________(只写一个)。
参考答案:(1)N P(填名称、符号均可) (2)CO CO2 (3)P2O5? 70
P2O5+3H2O(热)====2H3PO4,P2O5+H2O(冷)====2HPO3(任选其一)
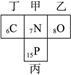
本题解析:甲与乙、丙、丁在元素周期表中的位置关系可能是下列情况之一:

设甲元素原子的最外层电子数为x。由(1)(2)得:
4x=20 ?x=5
由于甲、乙两元素的原子序数之和等于丙元素的原子序数。所以甲为氮,乙为氧,丙为磷,丁为碳(如下图)。
由(3)(4)得:4x?±1=20
?x无整数解,舍去。
本题难度:一般
4、选择题 当镁原子由1s22s22p63s2→1s22s22p63p2时,以下认识正确的是
A.镁原子由基态转化成激发态,这一过程中吸收能量
B.镁原子由激发态转化成基态,这一过程中释放能量
C.转化后位于p能级上的两个电子处于同一轨道,且自旋状态相同
D.转化后镁原子与硅原子电子层结构相同,化学性质相似
参考答案:A
本题解析:1s22s22p63s2为基态电子排布,1s22s22p63p2为激发态电子排布。由基态变为激发态是需要吸收能量的,因此A正确,B错误。根据洪特规则电子优先占据一个轨道,且自旋方向相同,C错。电子由基态变为激发态,并没有影响电子层结构,D错。所以正确的选项为A。
点评:根据构造原理、泡利原理和洪特规则,能量最低排布的就是基态电子排布,能量不是最低的排布就是激发态电子排布。
本题难度:一般
5、选择题 某元素的离子结构示意图为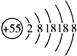 ,该元素在周期表中的位置是
,该元素在周期表中的位置是
A.第5周期零族
B.第6周期第IB族
C.第5周期第ⅦA族
D.第6周期第IA族
参考答案:D
本题解析:在元素的原子结构示意图中:电子层数=周期数,最外层电子数=主族序数,阴离子得电子带负电荷,阳离子失电子带正电荷。质子数-核外电子总数=电荷数。故选D。
点评:本题考查的是根据元素的原子(离子)结构示意图来判断元素在周期表中的位置,题目难度不大,熟记以下规律:在元素的原子结构示意图中:电子层数=周期数,最外层电子数=主族序数,阴离子得电子带负电荷,阳离子失电子带正电荷。质子数-核外电子总数=电荷数。再多加练习便很容易解得此类问题。
本题难度:一般