1、简答题 写出实验室制取氨气的化学方程式______,收集氨气用______法.氨水呈______性(填酸、碱、中).
参考答案:固体氯化铵和固体氢氧化钙反应的方程式为:Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O;
氨气极易溶于水,所以只能用排空气的方法收集,又因为氨气密度小于空气密度,所以选择向上排空气法收集;
氨气溶于水,发生反应NH3+H2O NH3?H2O,NH3?H2O是弱碱电离产生氢氧根离子,所以氨水呈碱性.
故答案为:Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O;向上排空气法;碱.
本题解析:
本题难度:一般
2、实验题 二氧化锰(MnO2)与浓盐酸混合加热可得到氯气,下图是制取并探究Cl2化学性质的装置图。
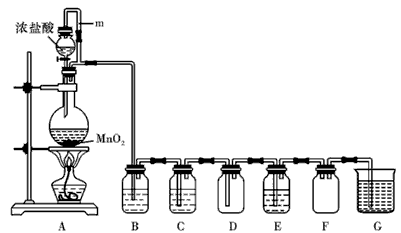
(1)圆底烧瓶中发生反应的化学方程式为______________ 。
(2)A 中m 管的作用是____________ 。
(3)若要得到干燥纯净的气体,则B中应盛放的试剂是_____________ 。
(4)E中若装有FeCl2 溶液,反应的离子方程式为 _______________;E中若装有淀粉碘化钾溶液,能观察到的实验现象是 _____________。
(5)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气。针对上述现象,某中学高一化学兴趣小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通入HCl气体,加热
b.稀盐酸滴入MnO2中,然后加入NaCl固体,加热
c.稀盐酸滴入MnO2 中,然后加入浓硫酸,加热
d.MnO2与NaCl的浓溶液混合,加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是______________ ; 实验c的目的是_____________ 。
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此得出影响氯气生成的原因是_____________ 。
参考答案:(1)MnO2+4HCl(浓)=== MnCl2+Cl2↑+2H2O
(2)连通圆底烧瓶和分液漏斗,平衡压强,使分液漏斗中的液体顺利流下
(3)饱和食盐水
(4)2Fe2++Cl2===2Fe3++2Cl-; 溶液变蓝
(5)①探究c(Cl-)对反应的影响;探究c(H+)对反应的影响; ②c(H+)的大小
本题解析:
本题难度:困难
3、选择题 下列说法不正确的是( ? )
A.实验室制备NH3可用NaOH固体和浓氨水为原料方便制得
B.二氧化硅是生产光纤制品的基本原料
C.工业制水泥、玻璃、陶瓷都要用到石灰石为原料
D.工业上可利用铝热反应原理制备高熔点金属
参考答案:C
本题解析:
本题难度:一般
4、实验题 (1)实验是化学研究的基础,下列有关说法中,正确的是_______(填序号字母)?。
a.可在耐高温的石英坩埚中进行熔化氢氧化钠固体的实验
b.用pH试纸测定溶液的pH时,不需用蒸馏水润湿试纸
c.实验室中不慎将酒精撒在台面上起火,可用湿抹布覆盖灭火
d.实验室取用少量白磷时,可将白磷取出,在空气中用小刀切割
(2)用分液漏斗和烧杯可以装配成一套简易的,能随开随用、随关随停的气体发生装置,如图所示。能用此装置制备的气体有_________(填序号字母)。
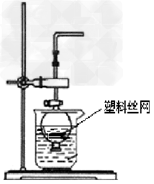
a.?用块状大理石与盐酸反应制取CO2?
b.?用锌粒与稀硫酸反应制取H2
c.?用过氧化钠与水反应制取O2
d.?用二氧化锰与浓盐酸反应制取Cl2
参考答案:(1)bc
(2)ab
本题解析:
本题难度:一般
5、简答题 化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养.
(1)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验.写出制取Cl2的离子方程式______;某小组要从该混合物中回收MnO2并提取MnCl2晶体,则要多次用到的玻璃仪器是______.
(2)下图A~G都是常见的与气体制备、收集、尾气吸收有关的装置.例如,B、C都可以收集H2、CH4、NH3、Cl2等.如果收集Cl2并进行尾气处理,不能选用______;如用B收集Cl2,应该从______(甲、乙)端进气.

(3)工业常用Cl2从海水中制备Br2,反应离子方程式是______.实验室模拟该实验,分离出Br2的操作是:取混合溶液于分液漏斗中,加入CCl4,振荡,静置分层,______.
(4)次氯酸盐有强氧化性,如NaClO可以氧化NH3制备高能燃料N2H4,反应方程式是:______.现有14.9gNaClO最多可以制备______molN2H4.
参考答案:(1)浓盐酸和二氧化锰在加热条件下能发生氧化还原反应生成氯化锰、氯气、水,二氧化锰、氯气、水在离子反应中应保留化学式,离子反应方程式为:MnO2+2Cl-+4H+△.Cl2↑+Mn2++2H2O,从该混合物中回收MnO2并提取MnCl2晶体,需通过过滤操作,滤渣为MnO2,具体操作为:①溶解,为了加速溶解而用玻璃棒搅拌;②过滤,过滤过程中为了防止液体外流而用玻璃棒引流;③蒸发,蒸发时为了避免液体局部过热造成液滴飞溅而用玻璃棒搅拌,
故答案为:MnO2+2Cl-+4H+△.Cl2↑+Mn2++2H2O;玻璃棒;
(2)氯气制备是固体和液体加热制备气体,可以通过饱和食盐水方法收集氯气,A可收集氯气的尾气,并能防止倒吸;B、C都可以收集Cl2;D无法将氯化钠溶液排到烧杯中,故D不符合;E从短口进氯气,可用排饱和食盐水的方法收集氯气;氯气有毒不能直接用排空气法收集,故F不符合,G用于吸收氯气;氯气比空气重,用向上排气法收集Cl2,如用B收集,需从乙口进氯气,
故答案为:DF;乙;
(3)氯气具有氧化性,能氧化溴离子生成单质溴:Cl2+2Br-=Br2+2Cl-,取混合溶液于分液漏斗中,加入CCl4,振荡,溶液由无色变为橙黄色,溶液分层,上层液体几乎为无色,下层液体为橙红色,为溴的四氯化碳溶液,从分液漏斗下端放出有机层,(从上端倒出水层),
故答案为:Cl2+2Br-=2Cl-+Br2;从分液漏斗下端放出有机层,(从上端倒出水层);
(4)NH3与NaClO反应得到肼(N2H4),氮元素化合价升高被氧化,次氯酸钠做氧化剂被还原为氯化钠,依据原子守恒配平写出化学方程式为2NH3+NaClO=N2H4+NaCl+H2O,现有14.9g NaClO,n(NaClO)=mM=14.9g74.5g/mol=0.2mol,由方程式可知,最多可以制备0.2molN2H4,
故答案为:2NH3+NaClO=N2H4+NaCl+H2O;0.2.
本题解析:
本题难度:一般