1、简答题 NH3在催化剂存在时能还原NOx为N2和H2O,这是目前国外硝酸厂进行尾气治理所普遍采用的一种方法.下图是某校化学兴趣小组设计的模拟氨气还原NO的装置.?

回答下列问题:
(1)若制取氨气用A装置,则发生反应的化学方程式为______.若用B装置制取氨气,则分液漏斗和锥形瓶中盛放的药品分别是______.
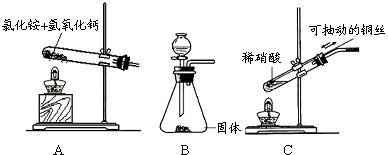
(2)若制取NO用图C装置,则制取NO的离子方程式为______,用可抽动的铜丝其优点是______.
(3)装置⑦的作用可能是______.
(4)活性亚铬酸铜(可写成xCuO?yCr2O3的形式,x、y为正整数)是氨气还原NO催化剂.已知CuNH4(OH)CrO4在295℃分解生成活性亚铬酸铜催化剂、一种无毒气体及水,写出该反应的化学方程式______.
(5)若进入装置⑤的NO共2688mL(已折算为标准状况,下同),氨气过量,最后收集到标准状况下2016mL?N2,则NO的转化率为______.
2、选择题 对于实验室制备乙烯的实验,下列说法正确的是
[? ]
A.烧瓶中先加入反应药品,然后检查仪器的气密性
B.所用的反应药品为1体积酒精和3体积浓度为 5 mol/L的硫酸
C.收集乙烯可用排水法,也可用排空气法
D.温度计要插入反应液体的液面下,以控制温度在170℃
3、选择题 实验室进行下列实验时,要用到温度计,且温度计水银球置于反应物液面以下的是( )
A.用蒸馏方法提纯水
B.乙醛的银镜反应
C.实验室制乙烯
D.实验室制取硝基苯
4、实验题 高纯氧化铁(α-Fe2O3)是现代电子工业的重要材料。实验室用硫铁矿烧渣(主要成分是Fe2O3、FeO、SiO2等)为原料制备高纯氧化铁的步骤如下:
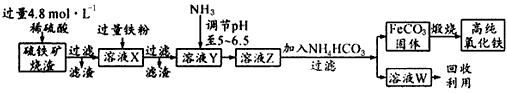
请回答下列问题:
(1)实验室用18.4 mol/L的浓硫酸配制250 mL 4 8 mol/L的硫酸溶液,所用的玻璃仪器除胶头滴管、量筒、烧杯、玻璃棒和酸式滴定管外,还需_________(填写仪器名称)。
(2)溶液X中加入铁粉后可能发生反应的离子方程式为______________________
(3)某同学选用下列装置来制备纯净干燥的氨气,请完成下列有关问题:
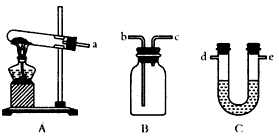
①装置A中可以选用下列试剂中的___________(填写序号字母);
a.(NH4)2SO4和生石灰 b.NH4Cl和Ca(OH)2固体 c.NH4HCO3固体 d.NH4Cl固体
②装置C中试剂最好选用_________(填写试剂名称);
③收集NH3时,气体应由_________(填写导管口代号)通入。
(4)写出氨水与NH4HCO3溶液反应的离子方程式__________________
5、选择题 实验室制Cl2的反应为4HCl(浓)十MnO2
MnCl2+Cl2↑+2H2O.下列说法错误的是( )
A.还原剂是HCl,氧化剂是MnO2
B.每生成1mol Cl2,转移电子的物质的量为2mol
C.每消耗1mol MnO2,起还原剂作用的HCl消耗4mol
D.生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质