1、实验题 甲苯氧化法制备苯甲酸的反应原理如下:
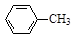 + 2KMnO4
+ 2KMnO4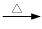
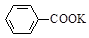 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
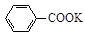 + HCl
+ HCl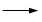
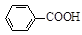 +KCl
+KCl
实验时将一定量的甲苯和KMnO4溶液置于图1装置中,在100 ℃时, 反应一段时间,再停止反应,并按如下流程分离出苯甲酸和回收未反应的甲苯。
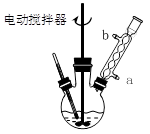 ?
?
图1回流搅拌装置?图2抽滤装置?
⑴实验室中实现操作Ⅰ所需的玻璃仪器有?、烧杯;操作Ⅱ的名称为?。
⑵如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,若无此操作会出现的危害是?。
⑶在操作Ⅲ中,抽滤前需快速冷却溶液,其原因是?;如图2所示抽滤完毕,应先断开?之间的橡皮管。
⑷纯度测定:称取1.220 g产品,配成100 mL溶液,取其中25.00 mL溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3 mol。产品中苯甲酸质量分数为?。
参考答案:⑴分液漏斗?蒸馏?⑵过量的高锰酸钾氧化盐酸,产生氯气
⑶得到较大的苯甲酸晶粒,便于抽滤?抽气泵和安全瓶? ⑷96%(每空2分,共12分)
本题解析:⑴操作I为分液操作,其所需的玻璃仪器有分液漏斗、烧杯;操作II为蒸馏操作得无色液体A。
⑵为了避免过量的高锰酸钾氧化盐酸,产生有毒的氯气,应该先加亚硫酸氢钾除去过量的高锰酸钾,然后再加入浓盐酸酸化。
⑶为了得到较大的苯甲酸晶粒,便于抽滤,应该在抽滤前需快速冷却溶液;为了避免管道里的水在负压下回流,故在抽滤完毕,应先断开抽气泵和安全瓶。
⑷根据“1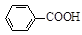 ~1KOH”,则产品中苯甲酸质量分数为
~1KOH”,则产品中苯甲酸质量分数为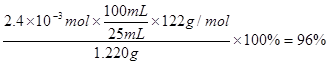 。
。
本题难度:一般
2、选择题 下列分离或提纯物质的方法错误的是
[? ]
A.用渗析的方法精制氢氧化铁胶体
B.用加热的方法提纯含有少量碳酸氢钠的碳酸钠
C.用溶解、过滤的方法提纯含有少量硫酸钡的碳酸钡
D.用盐析的方法分离、提纯蛋白质
参考答案:C
本题解析:
本题难度:简单
3、选择题 只用一种试剂就可以鉴别乙烯和甲烷的是
A.NaOH溶液
B.石蕊溶液
C.酚酞试剂
D.溴水
参考答案:D
本题解析:略
本题难度:简单
4、选择题 下列关于蒸馏操作的有关叙述不正确的是( )
A.蒸馏操作的主要仪器是:蒸馏烧瓶,酒精灯,铁架台,冷凝管,锥形瓶,温度计等
B.蒸馏操作使用的温度计的水银球应插人到液面下
C.在蒸馏烧瓶内放入少量碎瓷片
D.冷凝管进出的水的方向是下进上出
参考答案:B
本题解析:
本题难度:简单
5、选择题 已知Na2SO4和NaCl混合溶液中,Cl-的物质的量浓度是Na+的物质的量浓度的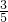 倍,下列叙述中正确的是
倍,下列叙述中正确的是
A.溶液中一定有1molNa2SO4和3molNaCl
B.所带电荷数SO42-是Na+的倍
C.SO42-与Cl-的物质的量之和等于Na+的物质的量
D.Na2SO4和NaCl的物质的量之比为1:3
参考答案:D
本题解析:分析:A、未给出溶液体积,无法得到具体的物质的量;
B、根据溶液呈电中性,阴阳离子所带电荷相等判断;
C、根据溶液呈电中性,阴阳离子所带电荷相等判断;
D、根据溶液呈电中性,阴阳离子所带电荷相等判断.
解答:A、未给出溶液体积,无法得到具体的物质的量,故A错误;
B、溶液呈电中性,由电荷守恒,所以2Q(SO42-)+Q(Cl-)=Q(Na+),由于Cl-的物质的量浓度是Na+的物质的量浓度的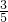 倍,所以Q(Cl-)=
倍,所以Q(Cl-)=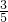 Q(Na+),使用Q(SO42-)=
Q(Na+),使用Q(SO42-)=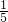 Q(Na+),故B错误;
Q(Na+),故B错误;
C、溶液呈电中性,阴阳离子所带电荷总数相等,所以2n(SO42-)+n(Cl-)=n(Na+),故C错误;
D、溶液呈电中性,阴阳离子所带电荷总数相等,所以2n(SO42-)+n(Cl-)=n(Na+),由于Cl-的物质的量浓度是Na+的物质的量浓度的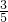 倍,所以n(Cl-)=
倍,所以n(Cl-)=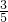 n(Na+),则n(SO42-)=
n(Na+),则n(SO42-)=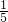 n(Na+),所以Na2SO4和NaCl的物质的量之比为1:3,故D正确.
n(Na+),所以Na2SO4和NaCl的物质的量之比为1:3,故D正确.
故选D.
点评:本题考查物质的量浓度的有关计算,难度不大,关键明白溶液呈电中性,阴阳离子所带电荷总数相等.
本题难度:一般