1、选择题 反应2A(g)?2B(g)+E(g)△H>0,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
A.加压
B.减压
C.减小E的浓度
D.降温
参考答案:A.增大压强,平衡向逆反应方向移动,A的浓度增大,正、逆反应速率都增大,故A错误;
B.降低压强,正、逆速率都减小,平衡向正反应方向移动,A的浓度降低,故B错误;
C.减少E的浓度,平衡向正反应方向移动,正、逆速率都减小,但A的浓度降低,故C错误;
D.降低温度,正、逆反应速率都减小,平衡向逆反应方向移动,A的浓度增大,故D正确.
故选B.
本题解析:
本题难度:简单
2、选择题 在固定容积的容器中盛有1molPCl5,200℃时发生如下反应:PCl5(g)?PCl3+Cl2(g)达到平衡时,PCl5体积分数为M%.若在同一温度和同一容器中,最初投入2molPCl5,达平衡时,PCl5所占体积分数为N%,则M和N的关系是( )
A.M<N
B.M>N
C.M=N
D.无法比较
参考答案:根据PV=nRT知,R为常数,当V、T相同时,n越大,P越大;该反应是气体体积增大的反应,当投入的物质的量加倍时,则相当于增大压强,平衡向气体体积减小的方向移动,即逆反应方向移动,所以导致反应达到平衡时PCl5的转化率减小,PCl5的体积分数增大,故M<N.
故选A.
本题解析:
本题难度:简单
3、填空题 反应A(g)+B(g) C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
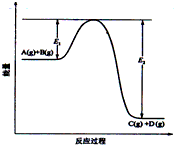
(1)该反应是_____________反应(填“吸热”“放热”)
(2)当反应达到平衡时,升高温度,A的转化率______(填“增大”“减小”“不变”),原因是________________________________________;
(3)反应体系中加入催化剂对反应热是否有影响?________,原因是_________________________
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”“减小、”“不变”)。
参考答案:(1)放热
(2)减小;该反应正反应为放热反应,升高温度使平衡向逆反应方向移动
(3)不影响;催化剂不改变平衡的移动
(4)减小;减小
本题解析:
本题难度:一般
4、选择题 在恒温时,一固定容积的容器内发生如下反应:2NO2(g) N2O4(g)达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数
N2O4(g)达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数
[? ]
A.不变
B.增大
C.减小
D.无法判断
参考答案:C
本题解析:
本题难度:一般
5、简答题 在80℃时,将0.40mol的N2O4气体充入1L固定容积的密闭容器中发生反应:N2O4═2NO2(△H>0),每隔一段时间对容器内的物质进行测定,得到如下数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100
n(N2O4)(mol)
0.40
a
0.20
c
d
e
n(NO2)(mol)
0.00
0.24
b
0.52
0.60
0.60
|
(1)在20s-40s之间,用N2O4表示的平均反应速率为______.
(2)在80℃时该反应的平衡常数K=______.
(3)要增大该反应的平衡常数,可采取的措施有(填序号)______.
①增大N2O4的起始浓度?②向混合气体中通入NO2
③使用高效催化剂?④升高温度
(4)反应进行至100s后若降低温度,混合气体的颜色______(填“变浅”、“变深”或“不变”).
(5)反应进行至100s后若向容器中再充入0.40mol的N2O4气体,则达到新平衡后N2O4的转化率将______(填“增大”、“减小”或“不变”).
参考答案:(1)生成0.24molNO2,消耗N2O4为0.12mol,则a=0.40-0.12=0.28mol,所以20s-40s之间,消耗N2O4为0.28mol-0.20mol=0.08mol,则20s-40s之间,用N2O4表示的平均反应速率为0.08mol/L20s=0.004?mol?L-1?s-1,故答案为:0.004?mol?L-1?s-1;
(2)由表格中的数据可知,平衡时,c(NO2)=0.6mol1L=0.6mol/L,c(N2O4)=0.4mol/L-0.3mol/L=0.1mol/L,
K=(0.6mol/L)20.1mol/L=3.6?mol?L-1,故答案为:3.6?mol?L-1;
(3)增大该反应的平衡常数,可使平衡正向移动,①②均使K减小,③使K不变,该反应为吸热反应,④升高温度平衡正向移动,K增大,故答案为:④;
(4)该反应为吸热反应,若降低温度,平衡逆向移动,二氧化氮的浓度减小,颜色变浅,故答案为:变浅;
(5)100s后若向容器中再充入0.40mol的N2O4气体,因容器的体积不变,相当于加压,化学平衡逆向移动,则达到新平衡后N2O4的转化率将减小,故答案为:减小.
本题解析:
本题难度:一般