1、填空题 (8分)中学化学中几种常见物质的转化关系如下:
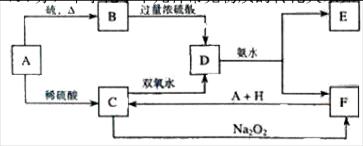
将 D滴入氢氧化钠溶液中可得到F的红褐色沉淀。请回答下列问题:
(1)A、B、C、D、 E、F、H的化学式:A?B __
E、F、H的化学式:A?B __ _________、D ___________、E?。
_________、D ___________、E?。
(2)写出 C的酸性溶液与双氧水反应的离子方程:________________________。
(3)写出鉴定E中阳离子的离子方程式:?。
参考答案:(1 )A :Fe?B: FeS ?D: Fe2(SO4)3 E:(NH4)2SO4。
(2)2Fe2+ + 2H+ + H2O2 = 2Fe3+ + H2O
(3)NH4++ OH-= NH3↑+ H2O
本题解析:略
本题难度:简单
2、填空题 (10分)已知常见金属单质A有以下物质相互转化
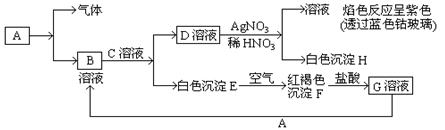
试回答:
(1)写出B的化学式?,D的化学式?。
(2)写出由E转变成F的化学方程式?。
(3)写出检验G溶液中的金属阳离子的试剂是(写化学式)?;向G溶液加入A的有关离子反应方程式?。
参考答案:(1).FeCl2? KCl(3)、KSCN
本题解析:焰色反应为紫色,证明此溶液阳离子为K+,H为白色沉淀为AgCl,可推出D为KCl溶液,白色沉淀E到红褐色沉淀F推出E为Fe(OH)2,F为Fe(OH)3,由D和E推出C为KOH溶液,B为FeCl2溶液,A为常见金属所以A为Fe,Fe+HCl=FeCl2+H2
(1)B的化学式为FeCl2,D的化学式为KCl
(2)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)检验Fe3+的试剂是KSCN溶液? 2Fe3++Fe=3Fe2+
本题难度:简单
3、选择题 X、Y、Z是原子序数依次增大的同一短周期元素.X为金属元素,X的单质能与冷水发生剧烈反应;Y的最外层电子数是核外电子层数的2倍,X与Y可形成化合物X2Y;Z单质为共用一对电子对的双原子分子.下列说法不正确的是( )
A. Y2-的还原性较Z-强
B.Y的氢化物与X2Y所含化学键的类型相同
C.YO2与Z2均可作为漂白剂,但起漂白作用的原理不同
D.以石墨为电极电解XZ的水溶液,在阴极附近滴入酚酞可观察到溶液显红色
参考答案:B
本题解析:
本题难度:简单
4、填空题 (10分)已知T、X、Y、Z是四种常见的短周期元素,其结构或性质信息如下表。请填空:

(1)写出与Y2互为等电子体的物质的分子式?。
(2)写出Y的最简单气态氢化物的结构式?。
(3)元素Q的原子序数比X与Z的原子序 数之和还多1。
数之和还多1。
①该元素基态原子的价电子排布式为? ?。
?。
②向含Q离子的水溶液中逐滴加入Y的简单氢化物的水溶液至过量,写出有关反应的离子方程式?、?。
参考答案:(每空2分 ,共10分)
,共10分)
(1)CO?(2)NH3的结构式
(3)① 3d104s1
②Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O
本题解析:略
本题难度:一般
5、简答题 图是A~G各物质间的转化关系,其中B、D为气态单质.

请回答下列问题:
(1)物质A和E的名称分别为______、______.
(2)反应①的化学方程式为______.
(3)反应②可选用不同的C物质来进行,若能在常温下进行,其化学方程为______;若只能在加热情况下进行,则反应物C应为______.
(4)工业上F可通过多种途径转化成G.
①在F溶液中加入适量氢碘酸,发生反应的离子方程式为______.
②将无水F在氮气做保护气下加热至300℃-350℃下,通入干燥H2,而制得G.该反应化学方程式为______.
参考答案:在二氧化锰催化条件下,C反应生成D且不需加热,双氧水水解生成水和氧气,所以C是双氧水,铁在D中点燃,所以D是氧气,铁在氧气中燃烧生成四氧化三铁;加热条件下,A和二氧化锰反应,能和二氧化锰反应的物质是浓盐酸、氯酸钾,B、D不是同一种物质,所以A是浓盐酸,B是氯气,铁和氯气反应生成氯化铁,所以F是氯化铁;四氧化三铁和浓盐酸反应生成氯化铁、氯化亚铁,所以G是氯化亚铁.
(1)通过以上分析知,A是浓盐酸,E是四氧化三铁;
故答案为:浓盐酸,四氧化三铁;
(2)加热条件下,浓盐酸和二氧化锰反应生成氯化锰、氯气和水,
反应方程式为:MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O;
(3)反应②可选用不同的C物质来进行,若能在常温下进行,双氧水分解生成水和氧气,
反应方程式为2H2O2?催化剂?.?2H2O+O2↑,若只能在加热情况下进行,反应物C是KClO3;
故答案为:2H2O2?催化剂?.?2H2O+O2↑,KClO3;
(4)①氯化铁和氢碘酸能发生氧化还原反应生成氯化亚铁和碘单质,离子方程式为:2Fe3++2I-=I2+2Fe2+;
故答案为:2Fe3++2I-=I2+2Fe2+;
②在氮气做保护气下加热至300℃-350℃下,氯化铁和氢气反应生成氯化亚铁、氯化氢,
反应方程式为 2FeCl3+H2?△?.?2FeCl2+2HCl.
故答案为:2FeCl3+H2?△?.?2FeCl2+2HCl.
本题解析:
本题难度:一般