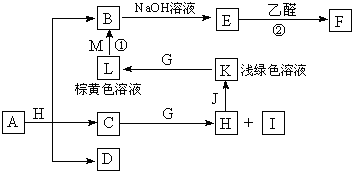
1、简答题 各物质之间的转化关系如图,部分生成物省略.C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板.
据此回答下列各题:
(1)写出纯净物A的化学式______,C的电子式______,用来检验L中阳离子的试剂是______(该试剂焰色为紫色).
(2)沉淀E可溶于过量______(填试剂名称)得到深蓝色的透明溶液,呈现该颜色是因为溶液中存在配离子______(填化学式).
(3)写出反应①的离子方程式______,写出反应②的化学方程式(有机物用结构简式表示)______.
(4)已知F溶于稀硝酸,溶液变成蓝色,放出无色气体,请写出该反应的化学方程式______.
参考答案:X在周期表中的原子半径最小,为H元素,Y、Z原子最外层电子数之和为10,“X、Y、Z的原子序数依次增大”,进而推出D(由H、C、O中的两种元素组成;无色非可燃性气体)为CO2,可以知道X、Y、Z是H、C、O,则C为H2O,H为HCl,I有漂白作用,应为HClO,浅绿色、棕黄色溶液为Fe2+和Fe3+,可知J为Fe,K为FeCl2,L为FeCl3,反应①用于制作印刷电路板为FeCl3和Cu,则M为Cu,B为CuCl2,E能与乙醛反应,应为Cu(OH)2,F为Cu2O,从A+H(HCl)=B(CuCl2)+C(H2O)+D(CO2)可知,A是含有Cu2+的碳酸盐,从A+H(HCl)=B(CuCl2)+C(H2O)+D(CO2)可知,A是含有Cu2+的碳酸盐,应为CuCO3或Cu2(OH)2CO3或Cu(OH)2?CuCO3,
(1)由以上分析可知A是CuCO3或Cu2(OH)2CO3或Cu(OH)2?CuCO3,C为H2O,电子式为
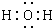
,L为FeCl3,用来检验L中阳离子的试剂是硫氰化钾,
故答案为:CuCO3或Cu2(OH)2CO3或Cu(OH)2?CuCO3;
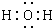
;硫氰化钾;
(2)E为Cu(OH)2,可与氨水发生络合反应生成[Cu(NH3)4]2+,得到深蓝色的透明溶液,
故答案为:氨水;[Cu(NH3)4]2+;
(3)反应①为氯化铁和铜的反应,反应的离子方程式为Cu+2Fe3+═Cu2++2Fe2+,乙醛和氢氧化铜浊液在加热的条件下反应的方程式为CH3CHO+2Cu(OH)2+NaOH△
本题解析:
本题难度:一般
2、推断题 A~J是中学化学中常见的几种物质,它们之间的转化关系如图所示。已知常温下A为固体单质,B为淡黄色粉末, C、F、I为气态单质,E在常温下为液体,且E可由C、F合成,J 可用作杀菌消毒剂。
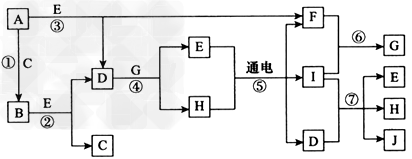
回答下列问题:
(1)B中的化学键有_____(填“离子键”或 “共价键”),E的电子式:____________。
(2)写出反应⑦的离子方程式:____________________。
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式:_________________
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则在_______(填“阴”或“阳”)极附近溶液由无色变为红色,其原因是____________。
参考答案:(1)离子键、共价键;
(2)Cl2+2OH-=Cl-+ClO-+H2O
(3)4AlCl3+6Na2O2+6H2O=4Al(OH)3↓+12NaCl+3O2↑
(4)阴;在阴极由于水电离产生的H+得到电子产生H2,破坏了水的电离平衡,促进水继续电离,导致溶液中c(OH-)>c(H+),溶液呈碱性,所以阴极附近溶液变为红色
本题解析:
本题难度:一般
3、简答题 Ⅰ有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的
倍.A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物.回答下列问题:
(1)写出相应元素符合,A______B______?C______?E______
(2)由A、C、D、E四种元素所组成的一种中学常见的化合物,它既能与盐酸反应,又能与NaOH溶液反应,在这种化合物的水溶液中,滴入紫色石蕊试液出现红色,则溶液中离子浓度由大到小的排列顺序为:______.
(3)将铝片和镁片.插入由A、C、D三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为______.
Ⅱ(5分)已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有右图所示的关系.
试回答下列问题
(1)G的化学式为:______.
(2)写出下列反应的化学方程式
①______?②______.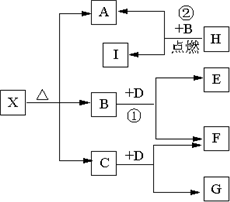
参考答案:Ⅰ、A元素的原子是半径最小的原子,应为H元素,B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,则B为N元素,对应的盐为NH4NO3,E元素的最外层电子数是次外层电子数的 34倍,应为S元素,D与A同族,且与E同周期,应为Na元素,A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物,则C应为O元素;
(1)由以上分析可知,A为H,B为N,C为O,E为S,故答案为:H,N,O,S;
(2)由A、C、D、E四种元素所组成的一种中学常见的化合物,它既能与盐酸反应,又能与NaOH溶液反应,
则该盐为NaHSO3,滴入紫色石蕊试液出现红色,说明HSO3-电离程度大于水解程度,则有c(H+)>c(OH-),
溶液中还存在水的电离,则c(H+)>c(SO32-),而HSO3-电离程度较小,则c(HSO3-)>c(H+),
所以有c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
(3)将铝片和镁片.插入由A、C、D三种元素组成物质为NaOH的稀溶液中构成原电池,铝做负极失电子发生氧化反应,镁做正极,溶液中氢离子得到电子生成氢气,则负极的电极反应式为:2Al-6e-+8OH-=2AlO2-+4H2O;故答案为:2Al-6e-+8OH-=2AlO2-+4H2O;
Ⅱ、由H是一种常见的金属单质,它在B中燃烧后生成一种非金属单质,我们可以推?知这种常见金属单质为金属镁,它在
CO2气体中燃烧生成C这种非金属单质.则A为?氧化镁;由X是一种盐,它受热分解可以产生MgO,因此X?可能为碳酸盐,但碳酸镁分解的产物只有氧化镁和二氧化碳,框图中的分解产物有三种,再由题示信息B(CO2)与D反应 ?可产生非金属单质F,且生成的E物质是工业上重要的碱,则可推断F是O2,D是Na2O2,E是Na2CO3,相应地推断出C是H2O,G是NaOH,那么X是一种碱式碳酸镁.
(1)由以上分析可知,G的化学式分别为NaOH,故答案为:NaOH;
(2)CO2与Na2O2反应生成2Na2CO3和O2,CO2与Mg反应生成MgO和C,
反应的方程式分别为2Na2O2+2CO2=2Na2CO3+O2和2Mg+CO2??点燃?.?2MgO+C,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;?2Mg+CO2??点燃?.?2MgO+C.
本题解析:
本题难度:一般
4、推断题 A、B、C、D、F五种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃气体。而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊。D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体。请回答下列问题:
(1)写出A、B、C、D、E、F的化学式 A________;B________;C________;D________;E________;F________。
(2)写出F和H反应的化学方程式 ____________________________。
(3)写出下列反应的离子方程式?:
①D+盐酸_____________________;
②B+水_______________________;
③D+A ______________________。
参考答案:(1)NaOH;Na;Na2CO3;NaHCO3;NaCl;Na2O2
(2)2Na2O2+2CO2===2Na2CO3+O2
(3)①HCO3-+H+===H2O+CO2↑;②2Na+2H2O===2Na++2OH-+H2↑;③ HCO3-+OH-===H2O+CO32-
本题解析:
本题难度:一般
5、简答题 如图是常见的一些单质及其化合物之间的转化关系图.常温常压下,D、F、K均为无色无刺激性气味的气体,C为活泼的金属单质,B是最常见的无色液体,A是有单质C在D中燃烧生成的淡黄色固体,I是焙制糕点所用的发酵粉的主要成分之一.(反应中生成的部分物质已略去)
请回答下列问题:
(1)K的分子式为______.
(2)物质A的常见用途为______(任写一种即可).
(3)反应①的离子方程式为______;反应②的化学方程式为______.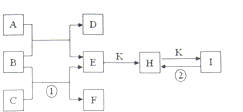
参考答案:A是有单质C在D中燃烧生成的淡黄色固体,淡黄色固体为Na2O2,则A为Na,C为O2,D为Na2O2,I是焙制糕点所用的发酵粉的主要成分之一,应为NaHCO3,B是最常见的无色液体,应为H2O,则E为NaOH,F为H2,K为CO2,H为Na2CO3,
(1)由以上分析可知K为CO2,故答案为:CO2;
(2)A为Na2O2,具有漂白性、氧化性,可与水或二氧化碳反应生成氧气,可用于供氧剂,故答案为:漂白剂或供氧剂;
(3)反应①为Na和水的反应,离子方程式为2Na+2H2O=2Na++2OH-+H2↑,NaHCO3不稳定,加热可分解生成Na2CO3和CO2,反应的方程式为2NaHCO3?△?.?Na2CO3+CO2↑+H2O,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;2NaHCO3?△?.?Na2CO3+CO2↑+H2O.
本题解析:
本题难度:一般