1、选择题 下列陈述Ⅰ、Ⅱ正确并且有因果关系的是? ( )。
选项
| 陈述Ⅰ
| 陈述Ⅱ
|
A
| SO2有漂白性
| SO2可使溴水褪色
|
B
| SiO2有导电性
| SiO2可用于制备光导纤维
|
C
| 浓硫酸有强氧化性
| 浓硫酸可用于干燥H2和CO
|
D
| Fe3+有氧化性
| FeCl3溶液可用于回收废旧电路板中的铜
|
?
参考答案:D
本题解析:A选项,SO2有漂白性,但其使溴水褪色是因为其具有还原性。B选项,SiO2没有导电性。C选项,浓硫酸有强氧化性,但不能氧化H2与CO,浓硫酸可用于干燥H2和CO是利用其吸水性。D选项,利用Fe3+的氧化性氧化铜生成Cu2+。
本题难度:一般
2、判断题 (12分)如图所示转化关系,判断A、B、C、D各是什么物质,写出有关的化学方程式。
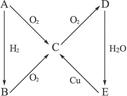
(1)当A为气体单质时,A是___________,B是___________,C是___________,D是
_____________,E是_____________。E→C化学方程式:_____________________________。
(2)当A为固体单质时,A是_________,B是__________,C是__________,D是___________,E_____________。E→C化学方程式:
_____________________________________________。
参考答案:(1)N2? NH3? NO? NO2? HNO3
3Cu + 8HNO3====3Cu(NO3)2+ 2NO↑+ 4H2O
(2)S? H2S? SO2? SO3? H2SO4
Cu +2H2SO4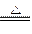 CuSO4+ SO2↑+ 2H2O
CuSO4+ SO2↑+ 2H2O
本题解析:由转化关系可知,A、B、C都具有还原性,即所含元素为变价化合物,A若为气体,则为氮及其化合物之间的转变,A若为固体,则为硫及其化合物之间的转变。
本题难度:简单
3、选择题 下列关于反应原理及对应说明的表述正确的是
[? ]
A.BaCO3与所有强酸反应的离子方程式都可表示为BaCO3+2H+=Ba2++H2O+CO2↑
B.工业上用于刻蚀铜制印刷电路板的离子方程式是Fe3++Cu=Cu2++Fe2+
C.SiO2+C Si+CO2↑是工业制取粗硅的反应
Si+CO2↑是工业制取粗硅的反应
D.由反应SO2+Cl2+2H2O=H2SO4+2HCl可知,向新制氯水中通入SO2,溶液的pH会减小
参考答案:D
本题解析:
本题难度:一般
4、选择题 氯气跟下列物质反应时,能够产生白雾的是( )
A.Na
B.Cu
C.H2
D.Fe
参考答案:A、Na为氯气反应生成固体氯化钠,会观察到白烟,故A不选;
B、Cu与氯气反应生成固体氯化铜,会观察到棕黄色的烟,故B不选;
C、H2与氯气反应生成气体HCl,极易结合水蒸气变为盐酸小液滴,则会观察到白雾,故C选;
D、Fe与与氯气反应生成固体氯化铁,会观察到棕褐色的烟,故D不选;
故选C.
本题解析:
本题难度:简单
5、实验题 (8分)欲用密度为1.18g/cm3(质量分数36.5%)的浓盐酸配制250mL1mol/L盐酸,回答下列各问:
(1)所需浓盐酸体积约为_______mL(填整数)。
(2)所需仪器为量筒、烧杯、滴管及_____、_______。
(3)若定容时俯视,所配溶液的物质的量浓度比要求的值________(填“偏高”或“偏低”)。
(4)若定容后再摇匀静置,发现凹液面低于刻度线。此时应该(填标号)_____。
A. 直接转移到试剂瓶中? B. 加水重新定容后贮存于容量瓶中
C. 重新定容后再转移到试剂瓶中
参考答案:(1)21
(2)玻璃棒、250mL容量瓶
(3)偏高
(4)A
本题解析:略
本题难度:简单