?
参考答案:
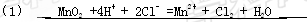 ? ?
Na2SO3__ .
(3)假设3:__只有ClO___.假设4:SO32-、ClO-都存在?
实验步骤
预期现象和结论
步骤1:取少量吸收液于试管中,滴加3 moL L-1 H2SO4至溶液呈酸 L-1 H2SO4至溶液呈酸 性,然后将所得溶液分置于A、B试管中. 性,然后将所得溶液分置于A、B试管中.

步骤2:在A试管中滴加紫色石蕊试液
若先变红后退 色,证明有ClO-,否则无 色,证明有ClO-,否则无
步骤3:在B试管中滴加0.01mol L-1KMnO4溶液 L-1KMnO4溶液
若紫红色退去,证明有SO32-,否则无
本题解析:略
本题难度:一般
2、实验题 某校化学实验兴趣小组为了验证在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),请按要求回答下列问题。

(1)下列方法中,可制得Cl2的正确组合是?。
①MnO2和浓盐酸混合共热;②MnO2、NaCl和浓硫酸混合共热;③NaClO和浓盐酸混合;④K2Cr2O7和浓盐酸混合;⑤KClO3和浓盐酸混合共热;⑥KMnO4和浓盐酸混合。
A.①②⑥? B.②④⑥
C.①④⑥? D.全部可以
(2)写出实验室制取Cl2的离子方程式?。
(3)①装置B的作用是?;
②装置C和D出现的不同现象说明的问题是?;
③装置E的作用是?。
(4)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出应该在装置?与?之间(填装置字母序号)增加一个装置,所增加装置里面的试剂可以为?(填字母序号)。
A.湿润的碘化钾淀粉试纸?B.浓硫酸
C.湿润的红色布条?D.饱和食盐水。
参考答案:(1)D
(2)4H++2Cl-+MnO2 2H2O+Cl2↑+Mn2+ 2H2O+Cl2↑+Mn2+
(3)①验证有水蒸气产生 ②Cl2无漂白性,次氯酸有漂白性 ③吸收Cl2
(4)E F B
本题解析:(1)题给选项的物质组合都能发生氧化还原反应,制取Cl2,故选D。(2)实验室制取Cl2的离子方程式为4H++2Cl-+MnO2 2H2O+Cl2↑+Mn2+。(3)①无水硫酸铜用来验证水蒸气的产生。②装置C和D出现的不同现象说明Cl2无漂白性,次氯酸有漂白性。③装置E的作用是吸收Cl2。(4)在E、F之间,增加盛装浓硫酸的装置,吸水干燥,从而保证通入F中的气体只有HCl。 2H2O+Cl2↑+Mn2+。(3)①无水硫酸铜用来验证水蒸气的产生。②装置C和D出现的不同现象说明Cl2无漂白性,次氯酸有漂白性。③装置E的作用是吸收Cl2。(4)在E、F之间,增加盛装浓硫酸的装置,吸水干燥,从而保证通入F中的气体只有HCl。
本题难度:一般
3、选择题 下列说法不正确的是( )
A.新制的饱和氯水呈浅黄绿色,久置后颜色逐渐变浅至无色
B.氯水有漂白性是因为HClO的强氧化性
C.漂白粉是混合物,其有效成分是氯酸钙
D.新制氯水与久置的氯水中加AgNO3溶液都能生成白色沉淀
参考答案:A、新制氯水含氯气,溶液盐酸为浅黄绿色,久置氯水中次氯酸见光分解生成盐酸和氧气,促进氯气和水的反应平衡进行彻底,溶液颜色变浅至无色,故A正确;
B、氯水有漂白性是因为HClO的强氧化性,能把有色物质氧化为无色物质,故B正确;
C、漂白粉是氯化钙和次氯酸钙的混合物,其有效成分是次氯酸钙,故C错误;
D、新制氯水与久置的氯水中都含有盐酸,有氯离子,加AgNO3溶液都能生成白色沉淀AgCl,故D正确;
故选C.
本题解析:
本题难度:简单
4、选择题 根据卤素性质的递变规律,推测原子半径最大的卤素-----砹(At)及其化合物不可能具有的性质是
A.砹单质为有色固体,易溶于有机溶剂;
B.HAt十分稳定;
C.AgAt为有色的、难溶于水的盐;
D.NaAt易溶于水。
参考答案:B
本题解析:同主族自上而下非金属性逐渐增强,相应氢化物的稳定性也是逐渐增强,HAt的稳定性最弱,选项B不正确,根据卤素元素及其单质的性质递变规律可知,其余都是正确的,答案选B。
本题难度:简单
5、选择题 向含有下列离子的溶液中,通入适量的氯气会引起离子浓度减少的是( )
①HCO3- ②SO32-③OH- ④Fe2+.
A.①②
B.③④
C.①②③
D.①②③④
参考答案:氯气通入溶液中,与水反应发生Cl2+H2O═HCl+HClO,
则①盐酸与HCO3-反应生成水和二氧化碳,引起离子浓度减少;
②盐酸与SO32-反应生成水和二氧化硫,引起离子浓度减少;
③盐酸与OH-反应生成水,引起离子浓度减少;
④次氯酸与Fe2+发生氧化还原反应,引起离子浓度减少;
故选D.
本题解析:
本题难度:一般
|