1、选择题 下列离子方程式书写正确的为( )
A.向硅酸钠溶液中通入过量的二氧化碳:SiO32-+CO2+H2O=H2SiO3↓+CO32-
B.向氯化铝溶液中加入过量的氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O
C.向澄清石灰水中滴加过量碳酸氢钙溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
D.向硝酸亚铁溶液中加入稀盐酸:Fe2++4H++NO3-=Fe3++NO↑+2H2O
参考答案:A、二氧化碳过量应生成碳酸氢根,离子方程式应为SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-,故A错误;
B、应生成氢氧化铝沉淀,不是偏铝酸根,应为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故B错误;
C、澄清石灰水中滴加过量碳酸氢钙,氢氧化钙与碳酸氢钙按1:1反应,生成碳酸钙、水为1:1,反应离子方程式为Ca2++HCO3-+OH-=CaCO3↓+H2O,故C正确;
D、电子转移不守恒、电荷不守恒,应为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,故D错误.
故选C.
本题解析:
本题难度:简单
2、选择题 下列有关的离子方程式正确的是
A.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O= +4
+4
B.铜片接电源正极,碳棒接电源负极,电解硫酸溶液:
C.磷酸一氢钠溶液水解: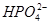 +H2O
+H2O
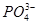 +H3O+
+H3O+
D.实验室配制的亚铁盐溶液在空气中被氧化:4Fe2++O2+2H2O=4Fe3++4OH-
参考答案:B
本题解析:A项,Al(OH)3不溶于氨水;B项,铜作阳极,铜被电解;C项:
 ;D项,应生成Fe(OH)3沉淀。
;D项,应生成Fe(OH)3沉淀。
本题难度:一般
3、选择题 下列离子方程式书写正确的是
[? ]
A.铝片放入NaOH溶液中:2Al + 2OH-= 2AlO2- + H2↑
B.碳酸钙溶于醋酸中:CaCO3 + 2H+= Ca2+ + CO2↑+ H2O
C.氯气通入NaOH稀溶液中:Cl2 + 2OH-= Cl-+ ClO-+ H2O
D.Ba(OH)2溶液与过量NaHSO4溶液混合:H+ + SO42-+ Ba2+ + OH-= BaSO4↓+ H2O
参考答案:C
本题解析:
本题难度:一般
4、填空题 用A、B、C、D、E和F表示含有10个电子的微粒(离子或分子),请回答:
(1)A离子为单核离子且A原子在所在周期中原子半径最大,A离子是______
(2)C是由两种元素组成的分子,其水溶液呈碱性,其分子式是______
(3)D是由两种元素组成的三原子分子,电子式是______
(4)向B中加入F先出现白色沉淀继续加入F沉淀溶解,写出该过程的离子方程式______
(5)E+F→C+D写出该方程式______.
参考答案:含有10个电子的微粒有:CH4、NH3、H2O、HF、NH4+、OH-、H3O+、O2-、F-、Na+、Mg2+、Al3+等,则
(1)A离子为单核离子且A原子在所在周期中原子半径最大,则A为Na元素,A离子是Na+,故答案为:Na+;
(2)由两种元素组成的分子,其水溶液呈碱性的物质是NH3,故答案为:NH3;
(3)由两种元素组成的三原子分子为H2O,其电子式为
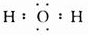
,故答案为:
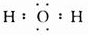
;
(4)向B中加入F先出现白色沉淀继续加入F沉淀溶解,则B为Al3+,F为OH-,反应的离子方程式分别有:
Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+H2O,
故答案为:Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+H2O;
(5)由以上分析可知E为NH4+,F为OH-,C为NH3,D为H2O,反应的离子方程式为NH4++OH-=NH3+H2O,
故答案为:NH4++OH-=NH3+H2O.
本题解析:
本题难度:一般
5、选择题 下列离子方程式中错误的是?( )
A.烧碱溶液与氯气的反应2OH-+Cl2=H2O+ClO-+Cl-
B.盐酸溶液与硝酸银溶液反应Cl-+Ag+=AgCl↓
C.少量铜屑放入浓硝酸溶液中Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
D.将稀硫酸滴在铜片上Cu+2H+=Cu2++H2↑
参考答案:A、因NaOH、NaCl、NaClO为强电解质,则烧碱溶液与氯气的离子反应2OH-+Cl2=H2O+ClO-+Cl-,故A正确;
B、AgCl不溶于水、不溶于酸,则盐酸溶液与硝酸银溶液的离子反应Cl-+Ag+=AgCl↓,故B正确;
C、在离子反应中单质、气体、水应保留化学式,则少量铜屑放入浓硝酸溶液中的离子反应为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,故C正确;
D、因Cu与稀硫酸不反应,则不能写出离子反应,故D错误;
故选D.
本题解析:
本题难度:一般