1、选择题 下列说法正确的是
[? ]
A.1 L水中溶解1 mol NaCl所形成溶液的物质的量浓度是1 mol/L
B.标准状况下,22.4 L HCl溶于1L水中形成溶液的体积是1L
C.标准状况下,将33.6 L HCl溶于水形成1L溶液,其物质的量浓度是1.5 mol/L
D.1 mol BaCl2溶于水形成1L溶液,所得溶液中c(Cl-)等于1 mol/L
参考答案:C
本题解析:
本题难度:简单
2、计算题 将一定量的碳酸钠和碳酸氢钠的混合物27.4 g ,跟含溶质0.4mol 的盐酸恰好反应,生成二氧化碳气体。(已知碳酸氢钠和盐酸反应的方程式如下:NaHCO3+HCl→NaCl+CO2↑+H2O )
(1)写出碳酸钠与盐酸反应的化学方程式
(2)求原混合物中碳酸钠和碳酸氢钠的质量各多少克?
(3)求生成的二氧化碳气体在标准状况下的体积。
参考答案:(1)Na2CO3+2HCl→2NaCl+CO2↑+H2O
(2)10.6克;16.8克
(3)6.72升
本题解析:
本题难度:一般
3、填空题 某同学用NaOH固体配制250mL?2mol/L的NaOH溶液,并进行有关实验.请回答下列问题:
(1)需要称取NaOH固体______g.
(2)配制该NaOH溶液时使用的仪器除托盘天平(砝码、镊子)、药匙、量筒、250mL容量瓶、胶头滴管外,还必须用到的仪器有______、______等.
(3)取所配制的NaOH溶液100mL,与一定质量的铝充分反应,铝全部溶解后,生成的气体在标准状况下的体积为3.36L,则参加反应的铝的质量为______g.
参考答案:(1)根据稀释定律,稀释前后溶质的物质的量不变,来计算NaOH固体的质量,设NaOH固体的质量为xg,则xg40g/mol=0.25L×2mol/L,解得:x=20,
所以应称取NaOH固体的质量是20g,故答案为:20;
(2)操作步骤有计算、称量、稀释、移液、洗涤移液、定容、摇匀等操作,用托盘天平称取氢氧化钠,在烧杯中稀释,用玻璃棒搅拌,冷却至室温后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切,盖好瓶塞颠倒摇匀.
所以需要的仪器为:玻璃棒、烧杯、胶头滴管、托盘天平、250mL容量瓶,
故答案为:玻璃棒;烧杯;
(3)设参加反应的铝的质量为x,则
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
54?22.4L×3
x?3.36L
所以54x=22.4L×33.36L?
解得? x=2.7g.
故答案为:2.7.
本题解析:
本题难度:一般
4、选择题 下列溶液中Cl-浓度与50 mL 1 mol·L-1 AlCl3溶液中Cl-浓度相等的是
[? ]
A.150 mL 1mol·L-1的NaCl溶液
B.75 mL 2mol·L-1 NH4Cl溶液
C.150 mL 3mol·L-1的KClO3溶液
D.75 mL 1mol·L-1的FeCl3溶液
参考答案:D
本题解析:
本题难度:简单
5、填空题 有五种物质是①6 g H2②0.5 mol CO2③1.204×10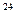 个氯化氢分子④147 g硫酸
个氯化氢分子④147 g硫酸
⑤92 g乙醇(C2H5OH),它们的物质的量最大的是?,所含分子数最多的是?,含有原子个数最多的是?,质量最大的是?。
参考答案:①?①?⑤?④
本题解析:首先“见量化摩”,以物质的量为核心再进行转换。
①n(H2)="3" mol
②n(CO2)="0.5" mol
③n(HCl)="2" mol
④n(H2SO4)="1.5" mol
⑤n(C2H5OH)="2" mol
所以物质的量最大的是①。因物质的量越大,所含分子数越多,所以所含分子数最多的也是①。
①~⑤含原子的物质的量分别为6 mol、1.5 mol、4 mol、10.5 mol、18 mol,故含原子个数最多的是⑤。
经计算可知质量最大的是④。
本题难度:简单