1、填空题 Ⅰ.磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图是?。?
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2 6CaSiO3+P4O10
6CaSiO3+P4O10
10C+P4O10 P4+10CO
P4+10CO
每生成1 mol P4时,就有??mol电子发生转移。?
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2 C6H6O6+2H++2I-
C6H6O6+2H++2I-
2S2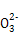 +I2
+I2 S4
S4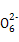 +2I-
+2I-
在一定体积的某维生素C溶液中加入a mol/L I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol/L Na2S2O3溶液V2 mL。该溶液中维生素C的物质的量是?mol。
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2I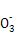 +5S
+5S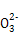 +2H+
+2H+ I2+5S
I2+5S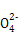 +H2O
+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。
某同学设计实验如下表所示:
?
| 0.01 mol/LKIO3酸性溶液(含淀粉)的体积/mL
| 0.01 mol/LNa2SO3溶液的体积/mL
| H2O的体积/mL
| 实验温度/℃
| 溶液出现蓝色时所需时间/s
|
实验1
| 5
| V1
| 35
| 25
| ?
|
实验2
| 5
| 5
| 40
| 25
| ?
|
实验3
| 5
| 5
| V2
| 0
| ?
|
?
该实验的目的是?;表中V2=??mL。
Ⅱ.稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
(5)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中,NH4Cl的作用是?。
(6)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
Ce3++H2O2+H2O Ce(OH)4↓+?。
Ce(OH)4↓+?。
参考答案:(1)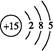
(2)20
(3)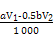 (或其他合理答案)
(或其他合理答案)
(4)探究该反应的速率与温度、亚硫酸钠溶液浓度的关系(或其他合理答案) 40
(5)分解出氯化氢气体,抑制CeCl3水解(或其他合理答案)
(6)2Ce3++1H2O2+6H2O 2Ce(OH)4↓+6H+
2Ce(OH)4↓+6H+
本题解析:Ⅰ.(1)P的原子序数是15,因此其原子结构示意图为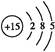 。
。
(2)P元素的化合价由+5价降到了P4中的0价,故每生成1 mol P4转移20 mol电子。
(3)根据化学方程式可知,I2的物质的量等于硫代硫酸钠的物质的量的一半加上维生素C的物质的量,则维生素C的物质的量为:(V1·a×10-3-0.5V2·b×10-3)mol。
(4)通过分析表中的数据可知,该实验研究的是温度、浓度对反应速率的影响;由于实验1和实验2的温度相同,故实验2与实验3的溶液的浓度一定相同,即水的体积一定相同,因此V2=40(mL)。
Ⅱ.(5)由于加热时氯化铵分解放出氯化氢气体,可以抑制CeCl3的
水解。
(6)分析反应可知,Ce3+化合价升高到了Ce(OH)4中的+4价,而H2O2中O的化合价由-1价降到-2价,根据电子守恒可确定Ce3+的化学计量数是2,而H2O2的化学计量数为1,再根据电荷守恒可知缺少的物质是H+,最后根据原子守恒配平反应:2Ce3++1H2O2+6H2O 2Ce(OH)4↓+6H+。
2Ce(OH)4↓+6H+。
本题难度:一般
2、填空题 (3分)工业上冶炼金属铁的主要反应为:Fe2O3 + xCO 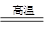 2Fe + 3CO2
2Fe + 3CO2
其中该化学方程式中x的数值是?, CO作?(填“氧化剂”或“还原剂”)。在该反应中,若消耗了1 mol Fe2O3,则生成?mol Fe。
参考答案:3,还原剂,2
本题解析:根据原子守恒可知,x=3;根据方程式可知,碳元素的化合价从+2价升高到+4价,失去电子,所以CO是还原剂;根据铁元素守恒可知,如果消耗了1 mol Fe2O3,则生成2mol单质铁。
点评:氧化还原反应的有关判断关键是准确判断元素化合价的变化。
本题难度:一般
3、填空题 (16分)写出下列反应的化学方程式或离子方程式。
(1)漂白粉溶液中通入过量的二氧化碳的化学方程式 ___________________________
(2)足量的氯气通入到溴化亚铁溶液中的离子方程式_________________________________
(3)硫酸工业生产中在接触室中发生的反应的化学方程式_____________________________
(4)碳和浓硫酸反应的化学方程式__________________________________
参考答案:
(1) Ca(ClO)2 + 2CO2 + 2H2O = 2HClO? +? Ca(HCO3)2
(2)3Cl2 + 2Fe2+? +? 4Br-? =? 6Cl- + 2Fe3+? +? 2Br2
(3)4FeS2 +11O2 ?2Fe2O3 + 8SO2
?2Fe2O3 + 8SO2
(4)SO2 + Br2 + 2H2O? =? 2HBr? + H2SO4
本题解析:
(1)这里是碳酸酸性强于次氯酸,先Ca(ClO)2 + CO2 + H2O =" 2HClO" + CaCO3↓,后是过量的二氧化碳:CO2 + H2O + CaCO3 = Ca(HCO3)2,两式叠加去掉碳酸钙即可。
(2)氯气能氧化二价铁和溴离子,先写出方程式:3Cl2+2FeBr2=2FeCl3+2Br2,然后改成离子方程式。
(3)制硫酸用的是黄铁矿即FeS2先锻烧后生成二氧化硫,再进一步氧化成三氧化硫,再用浓硫酸吸收生成的三氧化硫,在接触中则发生4FeS2+11O2=(高温)2Fe2O3+8SO2,配平时要注意其有两种元素变价。
(4)溴是卤族元素,很容易想到具有强氧化性,被还原成Br-,根据氧化还原反应的特点,二氧硫当体现还原性,在溶液中往往以SO42-的形式存在,先写出Br2+SO2→2Br-+ SO42-,剩余的部分通过原子守恒补足。
本题难度:一般
4、选择题 R2O8n-离子在一定条件下可把Mn2+氧化成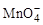 ,若反应后
,若反应后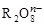 变成
变成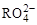 ,且反应中氧化剂与还原剂的离子个数比为5:2,则R2O8n-中R元素的化合价以及n分别为
,且反应中氧化剂与还原剂的离子个数比为5:2,则R2O8n-中R元素的化合价以及n分别为
A.+7,2
B.+6,2
C.+5,1
D.+4,1
参考答案:A
本题解析::R2O8n-中R化合价为+(8- ),Mn2+是还原剂,R2O8n-是氧化剂,根据得失电子相等得:5×2×(8-
),Mn2+是还原剂,R2O8n-是氧化剂,根据得失电子相等得:5×2×(8- -6)=2×(7-2)
-6)=2×(7-2)
解得:n=2。R2O82-中R化合价为+7。
点评:氧化还原反应计算关键是得失电子相等。
本题难度:一般
5、选择题 干燥剂的干燥性能值可用干燥效率(1?m3空气中实际残留水蒸气的质量)来衡量。某些干燥剂的干燥效率数据如下

根据以上数据,下列叙述错误的是
[? ]
A.上述干燥剂中阳离子对干燥效率的影响比阴离子小
B.干燥效率可能与干燥剂的阴、阳离子的半径大小有关
C.MgCl2可能是比CaCl2更好的干燥剂
D.MgO的干燥性能比CaO好
参考答案:A
本题解析:
本题难度:一般