|
高考化学知识点总结《电解池原理》考点巩固(2017年最新版)(四)
2017-11-05 23:33:42
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 15.有机电解制备的金属醇盐,可直接作为制备纳米材料的前体。以下是一种电化学合成金属醇盐的主要装置。
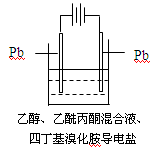
在电解过程中,已知乙醇和乙酰丙酮(CH3COCH2COCH3)在阴极发生的电极反应为:
2CH3CH2OH+2e-=2CH3CH2O-+H2↑
2CH3COCH2COCH3+2e—=2(CH3COCHCOCH3)+H2↑
下列说法正确的是
A.阳极Pb失去电子,发生还原反应
B.当阳极失去2 mol e—时,阴极产生2 mol氢气
C.电解过程中,阳离子向阴极移动
D.已知Pb-4e—=Pb4+,当消耗Pb的质量为103.5 g时,则转移电子2 mol
|
参考答案:CD
本题解析:A项阳极Pb失去电子,发生氧化反应;B项根据电极反应2CH3CH2OH+2e-=2CH3CH2O-+H2↑,阳极失去2mole-时,阴极产生1molH2;C项电解过程中,阳离子向阴极移动;D项根据电极反应Pb-4e—=Pb4+,当消耗Pb的质量为207g时,转移电子是4mol,当消耗Pb的质量为103.5g时,转移电子2mol。
考点:原电池和电解池的工作原理
点评:本题考查学生电解池的工作原理及电子守恒的计算,难度中等。
本题难度:一般
2、选择题 下图 为直流电源, 为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽、接通电路后发现上 为电镀槽、接通电路后发现上 的c点显红色.为实现铁上镀锌,接通 的c点显红色.为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述正确的是 后,使c、d两点短路.下列叙述正确的是
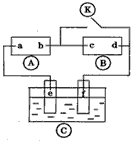
[? ]
A.a为直流电源的负极
B.c极发生的反应为2H++2e-=H2↑
C.f电极为锌板
D.e极发生还原反应
参考答案:B
本题解析:
本题难度:一般
3、填空题 (11分)H2O2是一种常用绿色氧化剂,在化学研究中应用广泛。
(1)请写出H2O2的电子式 。
(2)H2O2分解过程的能量变化如图(a)所示,
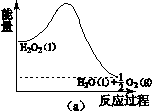
试判断该反应为 反应(吸热或放热)。
①已知:Fe3+催化H2O2分解的机理可分两步反应进行,
第一步反应为:2Fe3++H2O2=2Fe2++O2↑+2H+,
完成第二步反应的离子方程式:
 Fe2++ Fe2++  H2O2 + H2O2 +  _________ ="=" _________ ="="  _________+ _________+  _________ _________
②按图(b)装置(A、B瓶中已充有NO2气体,2NO2(g)  N2O4(g), ΔH<0)进行实验。可观察到B瓶中气体颜色比A瓶中的 (填“深”或“浅”),原因是 。 N2O4(g), ΔH<0)进行实验。可观察到B瓶中气体颜色比A瓶中的 (填“深”或“浅”),原因是 。

(3)空气阴极法电解制备H2O2的装置如图(c)所示,主要原理是在碱性电解质溶液中,利用空气中O2在阴极反应得到H2O2和稀碱的混合物。
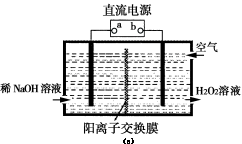
试回答:
①电源a极的名称是 。
②写出阴极电极反应式 。
(4)用H2O2和H2SO4的混合溶液可溶解印刷电路板中的金属铜,请写出铜溶解的离子方程式 ,控制其它条件相同,印刷电路板的金属粉末用10% H2O2和3.0 mol·L-1 H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
温度(℃)
| 20
| 30
| 40
| 50
| 60
| 70
| 80
| Cu的平均溶解速率
(×10-3mol·min-1)
| 7.34
| 8.01
| 9.25
| 7.98
| 7.24
| 6.73
| 5.76
|
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是 。
参考答案:(11分)
(1) (1分) (1分)
(2)放热 (1分)
①2 1 2H+ 2 Fe3+ 2H2O (2分)
②深 右侧烧杯由于H2O2分解放热水温升高,使上述平衡向逆向移动(2分)
(3)①正极 (1分)
②O2+2e-+2H2O=H2O2+2OH- (1分)
(4)H2O2+2H++Cu=Cu2++2H2O (1分)
温度升高H2O2分解速率加快,H2O2浓度降低,Cu的溶解速率降低 (2分)
本题解析:(1)H2O2为共价化合物,电子式为 ;(2)能量变化图可知,生成物H2O和O2的能量小于反应物H2O2的能量,所以该反应为放热反应;①Fe3+作催化剂,第二步生成Fe3+,H2O2被还原为H2O,离子方程式为2Fe2++ H2O2 +2H+ ==2Fe3++2H2O ;②右侧烧杯由于H2O2分解放热水温升高,使2NO2(g) ;(2)能量变化图可知,生成物H2O和O2的能量小于反应物H2O2的能量,所以该反应为放热反应;①Fe3+作催化剂,第二步生成Fe3+,H2O2被还原为H2O,离子方程式为2Fe2++ H2O2 +2H+ ==2Fe3++2H2O ;②右侧烧杯由于H2O2分解放热水温升高,使2NO2(g)  N2O4(g), ΔH<0,平衡向逆向移,B瓶中气体颜色比A瓶中的深;(3)空气中O2在阴极反应得到H2O2,b为负极,则①电源a极的名称是正极;②阴极电极反应式O2+2e-+2H2O=H2O2+2OH- ;(4)根据元素守恒和得失电子守恒可得方程式;升高温度,H2O2分解速率加快,H2O2浓度降低,Cu的溶解速率降低。 N2O4(g), ΔH<0,平衡向逆向移,B瓶中气体颜色比A瓶中的深;(3)空气中O2在阴极反应得到H2O2,b为负极,则①电源a极的名称是正极;②阴极电极反应式O2+2e-+2H2O=H2O2+2OH- ;(4)根据元素守恒和得失电子守恒可得方程式;升高温度,H2O2分解速率加快,H2O2浓度降低,Cu的溶解速率降低。
考点:反应热、离子方程式、化学平衡、电化学
本题难度:困难
4、选择题 右图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,合这一情况的是
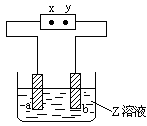
| a极板
| b极板
| x电极
| Z溶液
| A
| 锌
| 石墨
| 负极
| CuSO4
| B
| 石墨
| 石墨
| 负极
| NaOH
| C
| 银
| 铁
| 正极
| AgNO3
| D
| 铜
| 石墨
| 负极
| CuCl2
|
参考答案:A
本题解析:通电后发现a极板质量增加,说明a电极是阴极,则X是电源的负极。b极板处有无色无臭气体放出,则b电极是阳极,溶液中的OH-放电,生成的气体是氧气,所以符合条件的是选项A,答案选A。
考点:考查电化学的综合应用和判断
点评:该题是中等难度的试题,也是高考中的常见题型。试题基础性强,侧重对学生能力的培养和方法、技巧的指导。该题的关键是明确电解池中阴阳离子的放电顺序,然后结合题意灵活运用即可。
本题难度:简单
5、选择题 下列化学反应对应的离子方程式书写正确的是
A.醋酸溶液与Mg(OH) 2反应:Mg(OH) 2 +2H+ ===Mg2+ +2H2O
B.碳酸钠溶液呈碱性:CO32— +2H2O  H2CO3 +2OH— H2CO3 +2OH—
C.NH4HC03溶液与过量NaOH溶液反应:NH4+ +OH— ===NH3·H2O
D.用惰性电极电解饱和食盐溶液:2Cl—+2H2O 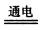 2OH— +Cl2↑+H2↑ 2OH— +Cl2↑+H2↑
|  2OH— +Cl2↑+H2↑,故D正确。
2OH— +Cl2↑+H2↑,故D正确。