1、选择题 为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列操作。其正确的操作顺序是
[? ]
①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量的Na2CO3溶液 ⑤加过量的BaCl2溶液
A.①④②⑤③
B.④①②⑤③
C.②⑤④①③
D.⑤②④①③
参考答案:CD
本题解析:
本题难度:一般
2、选择题 下面实验操作可以实现实验目的是( )
A.将温度计水银球插入蒸馏烧瓶的石油中来蒸馏石油
B.将SO2通入酸性KMnO4溶液中,溶液褪色,证明SO2具有漂白性
C.取样灼烧,可以鉴别某白色纺织品是棉织品还是羊毛制品
D.取少量蔗糖溶液加稀硫酸,水浴加热几分钟后,再加入新制的氢氧化铜悬浊液并且加热,观察现象,判断蔗糖水解的产物中是否含有葡萄糖
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列实验方案能达到预定目的的是
[? ]
A.将SO2通入石蕊溶液中证明SO2有漂白性
B.用绿豆大小的钠和钾分别与冷水反应说明钠、钾金属性的强弱
C.向某未知溶液中加入BaCl2溶液后再加入稀硝酸,检验是否含SO42-
D.用干燥的pH试纸测得新制氯水的pH为2
参考答案:B
本题解析:
本题难度:一般
4、填空题 某白色粉末由碳酸钠、硝酸镁、硫酸铜、氯化钾、氯化铵中的一种或几种组成.为了检验它们所含的物质,做了以下实验.①取部分粉末,加水溶解,得无色溶液.将所得溶液分成两份,分别进行实验;②在第一份溶液中滴加足量稀盐酸,有气泡产生,继续往反应后的溶液中滴加AgNO3溶液有白色沉淀生成;③在第二份溶液中滴加氢氧化钠溶液并加热,将湿润的红色石蕊试纸放在试管口,试纸变蓝.由此可判断固体混合物中肯定含______(写化学式,下同),肯定没有______,可能含有______.对可能有的物质,可采用______来检验,如果含有该物质,其现象是______.步骤③中有关的化学方程式为:______.
参考答案:根据①溶于水得无色溶液,由于硫酸铜为蓝色溶液,则一定不存在CuSO4;
根据②滴加足量稀盐酸,有气泡产生,产生气体只能为二氧化碳,说明一定存在Na2CO3;继续往反应后的溶液中滴加AgNO3溶液有白色沉淀生成,白色沉淀为氯化银,由于加入了稀盐酸,无法判断原溶液是否含有氯离子,即无法确定是否含有KCl;
根据③滴加氢氧化钠溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,该气体为氨气,证明原溶液中存在NH4Cl,
所以原固体物质中肯定含有的为:Na2CO3、NH4Cl;肯定没有CuSO4;可能含有KCl;
若要检验氯化钾,可以通过焰色反应进行检验,透过蓝色钴玻璃观察火焰颜色呈紫色,证明存在氯化钾,否则一定不存在氯化钾;
反应③为氢氧化钠与氯化铵的反应,在加热条件下,氯化铵与氢氧化钠反应生成氯化钠、水和氨气,反应的化学方程式为:NH4Cl+NaOH△.NaCl+NH3↑+H2O,
故答案为:Na2CO3、NH4Cl;CuSO4;KCl;焰色反应;透过蓝色钴玻璃观察火焰颜色呈紫色;NH4Cl+NaOH△.NaCl+NH3↑+H2O.
本题解析:
本题难度:一般
5、简答题 在除杂质的实验操作中,为了将溶液中的杂质完全去除,通常需加入过量的除杂质试剂.某校化学课外活动小组为了除去粗盐中含有少量Na2SO4、MgCl2,设计了下列实验步骤:
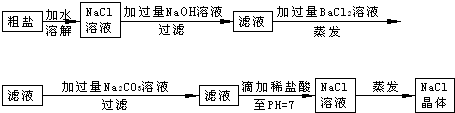
试简要说明:
(1)加入过量BaCl2的溶液的原因______.
(2)判断BaCl2已过量的方法是______
(3)加入过量Na2CO3的溶液的原因______.
(4)滴加稀盐酸直至pH=7的目的是______;写出这时反应的化学方程式______.
参考答案:(1)在粗盐提纯时,加入过量的氯化钡的目的是除去硫酸根离子,并将之除尽,故答案为:使硫酸根离子完全沉淀而除去;
(2)氯化钡过量时,加入硫酸会产生白色沉淀,可以通过检验钡离子来确定氯化钡是否过量,故答案为:取少量上层清液加入到试管中,向其中滴加稀硫酸,如果产生白色沉淀,证明氯化钡过量;
(3)粗盐溶液中的钙离子可以加碳酸钠来去除,所以碳酸钠的作用是:使钡离子完全沉淀而除去,故答案为:使钡离子完全沉淀而除去;
(4)在粗盐提纯时,最后一步加盐酸,滴加稀盐酸可以除去过量的氢氧根和碳酸根,发生的反应有:
HCl+NaOH=NaCl+H2O,2HCl+Na2CO3=2NaCl+H2O+CO2↑,最后得到氯化钠溶液,
故答案为:除去过量的氢氧根和碳酸根,得到氯化钠溶液;HCl+NaOH=NaCl+H2O,2HCl+Na2CO3=2NaCl+H2O+CO2↑.
本题解析:
本题难度:一般