|
高考化学知识点归纳《化学反应进行的方向》高频试题巩固(2017年最新版)(二)
2017-11-05 23:38:44
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 下列变化过程中,ΔS<0的是
A.氯化钠溶于水中
B.NH3(g)和HCl(g)反应生成NH4Cl
C.干冰的升华
D.CaCO3(S)分解为CaO(S)和CO2(g)
|
参考答案:B
本题解析:NH3(g)和HCl(g)反应生成NH4Cl,由气体生成了固体,混乱度减小,ΔS<0。
本题难度:一般
2、选择题 已知反应:2CO(g)=2C(s)+O2(g)。设△H和△S不随温度而变,下列说法中正确的是(? )
A.低温下是自发反应
B.高温下是自发反应
C.低温下是非自发反应,高温下是自发反应
D.任何温度下都是非自发反应
参考答案:D
本题解析:气体系数减小,则该反应的△S减小;该反应为吸热反应,△H大于0,则△G=△H—T△S任何温度下都大于为,反应均是非自发反应,答案为D
本题难度:简单
3、选择题 下列说法不正确的是
A.吸热反应可以自发进行
B.所有自发过程都将导致体系的熵值增大
C.有序性越高,熵值就越低
D.对于同种物质,在气态时其熵值最大
参考答案:B
本题解析:考查反应的方向
A:当ΔS增大时,对于吸热反应在较高温度下也可自发进行,正确
B:部分自发反应也可能导致体系熵值减小,错误
CD:正确
本题难度:简单
4、计算题 (6分)如图所示,当关闭阀门K时,向甲中充入1.5 mol A、3.5 mol B,向乙中充入 3 mol A、7 mol B,起始时,甲、乙体积均为V? L。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:3A(g)+2B(g)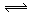 C(g) C(g) +2D(g);ΔH<0 +2D(g);ΔH<0
达到平衡(Ⅰ)时,V(乙)=0.86V? L。
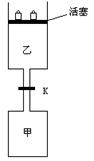
请回答:
(1)乙中B的转化率为?;
(2)甲中D和乙中C的物质的量比较:?(填“相等”、“前者大”、“后者大”);
(3)打开K,过一段时间重新达平衡(Ⅱ)时,乙的体积为?(用含V的代数式表示,连通管中气体体积忽略不计。)
参考答案:(1)20%?(2)后者大?(3)0.72V
本题解析:(1)? 3A(g)+2B(g)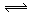 C(g) C(g) +2D(g) +2D(g)
起始量(mol)? 3? 7? 0? 0
转化量(mol)? 3x? 2x? x? 2x
平衡量(mol)? 3-3x? 7-2x? x? 2x
则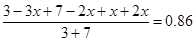
解得2x=1.4
所以B转化率是1.4÷7×100%=20%
(2)甲是保持等温等容的,而乙是保持等温等压的。又因为反应是体积减小的可逆反应,所以乙中反应物的转化率高于甲中反应物的转化率,因此乙中C的物质的量多。
(3)打开K,则相当于是等温等压下的可逆反应,因此和原来乙中平衡是等效的。此时消耗B是10.5mol×0.2=2.1mol,则消耗A是2.1mol÷2×3=3.15mol,生成C和D分别是1.05mol和2.1mol,如果设平衡时容器的总体积是X,则有
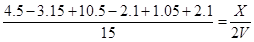
解得X=1.72VL
所以乙的体积为1.72VL-VL=0.72V。
本题难度:一般
5、选择题 将2molS02和2molO2放入一个容器中,在一定的条件下反应到达平衡状态,此时,容器存在的各物质的量中,下列可能存在的是( )
A.0molS02
B.2molS03
C.1mol02
D.1molSO3
参考答案:根据反应2SO2(g)+O2(g)?2SO3(g),将2molS02和2molO2放入一个容器中,反应物中的任何一方不可能完全转化为生成物.
A、反应是可逆的,2mol二氧化硫不可能完全被消耗,故A错误;
B、反应是可逆的,2mol二氧化硫不可能完全被消耗,也就不会生成2mol三氧化硫,故B错误;
C、反应是可逆的,2mol二氧化硫不可能完全被消耗,也就是氧气的消耗量不可能是1mol,所以不会剩余氧气1mol,故C错误.
D、当生成1mol三氧化硫时,消耗氧气和二氧化硫的量分别是0.5mol和1mol,符合可逆反应的特点,故D正确.
故选D.
本题解析:
本题难度:一般
|