1、选择题 11.6 gFe3O4加到100 mL某浓度的盐酸中,再加入 9.8 g铁粉,反应停止时,溶液中无固体存在。向溶液中滴加硫氰化钾溶液,未见颜色变化,为了中和过量的盐酸(不考虑盐酸的挥发),且使铁完全转化成Fe(OH)2, 共消耗5.0 mol·L-1 NaOH溶液160 mL。则原盐酸的物质的量浓度为?
[? ]
A.2 mol·L-1
B.4 mol·L-1
C.6 mol·L-1
D.8 mol·L-1
2、填空题 将2.5 g Na2CO3、NaHCO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入
1 mol/L的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示
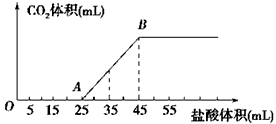
(1)写出OA段所发生反应的离子方程式__________________________。
(2)当加入35 mL盐酸时,产生CO2的体积为________mL(标准状况)。
(3)计算原混合物中NaOH的质量及碳酸钠的质量分数。
3、选择题  铜投入一定量的浓HNO3中,铜完全溶解,生成的气体颜色越来越浅,共收集到标准状况下
铜投入一定量的浓HNO3中,铜完全溶解,生成的气体颜色越来越浅,共收集到标准状况下 气体。将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的O2恰好使气体完全溶于水中,则通入的O2体积是
气体。将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的O2恰好使气体完全溶于水中,则通入的O2体积是
[? ]
A.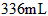
B.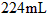
C.
D.
4、计算题 变压器的硅钢片含硅40%,其余为铁。则硅钢片中硅和铁的原子个数比多少?
若向7g该硅钢片中加入100g6.0%的烧碱溶液,充分反应后,求生成氢气在标准状况下的体积。
5、填空题 盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。请回答下列问题:
(1)常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有_________?性。用玻璃棒蘸取浓硫酸滴在纸上,纸逐渐变黑,说明浓硫酸具有____________性。
(2)①在100mL?18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是?______________。 ?
?A.40.32L?B.30.24L?C.20.16L?D.13.44L
②若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式_____________?。
(3)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水。该反?应的化学方程式为______________?。
(4)分别将等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出溶液呈“绿色”可能是溶液中Cu2+与NO2共存的结果,请你设计实验探究此说法正确与否(简述实验方案和实验现象及由此得出的结论)______________。