1、选择题 相同质量的铝分别与足量的稀盐酸和氢氧化钠溶液反应,下列说法不正确的是( )
A.相同条件下,产生气体的体积相等
B.生成的铝的化合物的物质的量相等
C.消耗酸和碱的物质的量相等
D.相同条件下,转移的电子数相等
参考答案:Al与HCl、NaOH反应方程式分别是:2Al+6HCl═2AlCl3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
A.根据2Al---3H2知,相同质量的Al生成的气体体积在相同条件下相等,故A正确;
B.根据Al原子守恒2Al---2AlCl3---2NaAlO2知,生成的铝的化合物的物质的量相等,故B正确;
C.根据Al---3HCl、Al---NaOH知,消耗酸和碱的物质的量不等,故C错误;
D.两个方程式中,都是Al失电子发生氧化反应,在足量的HCl和NaOH溶液中,则相等质量的铝失去电子数相等,故D正确;
故选C.
本题解析:
本题难度:一般
2、计算题 (10分)为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验。
(1)若取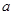 g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为
g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为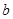 L。反应的化学方程式是_________________。样品中铝的质量是____________g。
L。反应的化学方程式是_________________。样品中铝的质量是____________g。
2)若取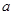 g样品在高温下将其恰好完全反应,该反应的化学方程式是:__________________,氧化铁和铝的质量比是____________。
g样品在高温下将其恰好完全反应,该反应的化学方程式是:__________________,氧化铁和铝的质量比是____________。
(3)待(2)中反应产物冷却后,加入足量盐酸,测得生成的气体积为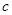 L,该气体与(1)中所得气体的体积比
L,该气体与(1)中所得气体的体积比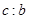 =_________。
=_________。
参考答案:.(每空2分,10分)
(1)_2Al+2NaOH+2 H2O =2NaAlO2+3H2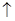 ? _45b/56或9b/11.2 _g。
? _45b/56或9b/11.2 _g。
(2): 2 Al + Fe 2O3_="_2" Fe +_Al 2O3(条件不写扣1分),80:27。
(3? 2:3
本题解析:略
本题难度:一般
3、计算题 (8分)把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入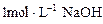 溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示。
溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示。
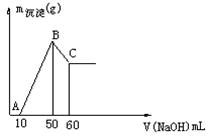
求:(1)合金中镁、铝各自的质量。
(2)盐酸的物质的量浓度。
参考答案:(1)镁:0.12g;铝:?0.27g?(2)0.5 mol/L
本题解析:略
本题难度:简单
4、选择题 铝具有较强的抗腐蚀能力,主要原因是( )
A.铝的化学性质稳定
B.铝与氧气在常温下不反应
C.铝在任何条件下均不与氧气反应
D.铝与氧气化合形成一层致密的氧化膜
参考答案:A、因铝的化学性质比较活泼,故A错误;
B、因常温下铝就会与氧气等反应,故B错误;
C、因铝常温下会与氧气生成氧化铝,故C错误;
D、因铝与氧气反应其表面生成一层致密的氧化铝保护膜,使铝有很好的抗腐蚀性,故D正确;
故选D.
本题解析:
本题难度:简单
5、选择题 将100mL 0.6 mol/L氯化铝溶液跟1mol/L氢氧化钠溶液混合后,得到3.9g Al(OH)3?沉淀,此时消耗氢氧化钠溶液的体积是
A.130mL
B.180mL
C.190mL
D.240mL
参考答案:C
本题解析:氯化铝的物质的量=0.1L×0.6mol/L=0.06mol
最终生成的氢氧化铝的质量是3.9g,物质的量=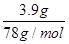 =0.05mol<0.06mol
=0.05mol<0.06mol
这说明反应中铝元素没有完全转化为氢氧化铝沉淀,如果氯化铝过量,则根据方程式可知:
Al3+?+? 3OH-=Al(OH)3↓
1mol? 3mol? 1mol
0.05mol? 0.15mol? 0.05mol
所以消耗氢氧化钠溶液的体积=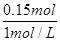 =0.15L=150ml
=0.15L=150ml
如果反应中氯元素部分转化为AlO2-,则根据方程式可知
Al3+?+? 3OH-=Al(OH)3↓
1mol? 3mol? 1mol
0.06mol? 0.18mol? 0.06mol
其中又被氢氧化钠溶液溶解的氢氧化铝是0.06mol-0.05mol=0.01mol
Al(OH)3?+ OH-=AlO2-+2H2O
1mol?1mol
0.01mol? 0.01mol
则最终消耗氢氧化钠的物质的量是0.18mol+0.01mol=0.19mol
因此消耗氢氧化钠溶液的体积=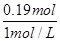 =0.19L=190ml,所以答案选C。
=0.19L=190ml,所以答案选C。
本题难度:一般