1、选择题 下列物质中,属于酸性氧化物但不溶于水的是:(?)
A.CO2
B.SiO2
C.SO3
D.Fe2O3
参考答案:B
本题解析:A,B,C都是酸性氧化物。D不是酸性氧化物。
B不能溶于水,所以答案选B。
本题难度:简单
2、简答题 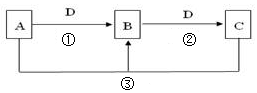
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是?,工业上制取A的离子方程式Ⅰ为?。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为 ?。
(3)若D是氯碱工业的主要产品,B有两性,则反应②的离子方程式是?。
(4)若A、C、D都是常见气体,C是形成酸雨的主要气体,则反应③的化学方程式?;
(5)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
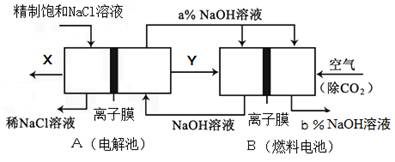
(6)Ⅰ①图中X、Y分别是?(填化学式),分析比较图示中氢氧化钠质量分数a%?b%(填“>”、“=”或“<”)
②写出燃料电池B中负极上发生的电极反应?。
参考答案:(1)FeCl3? 2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
(2)4NH3+5O2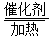 4NO+6H2O
4NO+6H2O
(3)Al(OH)3+OH-=AlO2-+2H2O
(4)2H2S+SO2=3S↓+H2O
(5)① Cl2? H2?>?② H2-2e-+2OH-=2H2O
本题解析:(1)若A可用于自来水消毒,应为Cl2,D是生产、生活中用量最大、用途最广的金属单质,应为Fe,则B为FeCl3,C为FeCl2,工业上制取A的离子方程式为2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
(2)若A是一种碱性气体,常用作制冷剂,应为NH3,B是汽车尾气之一,遇空气会变色,应为NO,反应①的化学方程式为4NH3+5O2 4NO+6H2O。(3)若D是氯碱工业的主要产品,B有两性,由转化关系D为NaOH,B为Al(OH)3,C为NaAlO2,反应②的离子方程式是Al(OH)3+OH-=AlO2-+2H2O。
4NO+6H2O。(3)若D是氯碱工业的主要产品,B有两性,由转化关系D为NaOH,B为Al(OH)3,C为NaAlO2,反应②的离子方程式是Al(OH)3+OH-=AlO2-+2H2O。
(4)若A、C、D都是常见气体,C是形成酸雨的主要气体,应为SO2,则A为H2S,D为O2,B为S,反应③的化学方程式是2H2S+SO2=3S↓+H2O
(5)①在燃料电池中,氧气作正极,所以通入空气的极是正极,通入燃料的极是负极,即产生Y的极是阴极,所产生的是氢气,在X处产生的是氯气,氢氧燃料电池最后产生的是水,所以a%大于b%;
②燃料电池的工作原理:负极是燃料氢气发生失电子的氧化反应,电极反应式为H2-2e-+2OH-=2H2O。
本题难度:一般
3、填空题 (10分)A是一种强酸,其浓度超过40%时就会迅速分解,产生比它的酸性更强的酸B,同时放出气体C和D,该气体经干燥后,平均分子量为47.6,所得气体通过80℃NaOH溶液,得到的产物中一种是A的钠盐,同时还剩余一种可以使带火星的木条复燃的气体D。试完成下列各题:
(1)确定各物质的化学式A________、B________、C________、D____________;
(2)气体C和D的体积比__________ _____;
_____;
(3)写出A分解方程式并配平;?;
(4)写出气体C与湿润的淀粉-碘化钾试纸的反应方程式_____________________;
(5)写出将气体C通过80℃NaOH溶液时发生的反应方程式___________________。
参考答案:1.A:HClO3? B:HClO4? C:Cl2? D:O2(各1分)
2.气体组成为O2︰Cl2=3︰2(2分)
3.8HClO3=4HClO4+3O2↑+2Cl2↑+2H2O(2分)
4.2KI+Cl2=2KCl+I2?
5.3Cl2+6NaOH=5NaCl+NaClO3+3H2O(2分)
本题解析:略
本题难度:一般
4、选择题 下列叙述正确的是
A.Fe分别与氯气和稀盐酸反应所得氯化物相同
B.某无色溶液中通入Cl2,溶液变为淡黄色,再加入淀粉溶液,溶液变为蓝色,说明原溶液中存在I-
C.CO2、NO2、SO2都能与H2O反应,其反应原理相同
D.C、N、S三种单质直接与O2反应都能生成两种氧化物
参考答案:B
本题解析:A项,铁和氯气反应生成氯化铁,和盐酸反应生成氯化亚铁,故错误;B项,淀粉遇碘变蓝色,淀粉溶液变蓝色,说明含有碘单质,碘溶于水呈黄色,原溶液呈无色,说明原溶液中不含碘单质,所以碘单质只能是氯气和碘离子反应生成的,所以原溶液中含有碘离子,故正确;C项,二氧化碳和二氧化硫与水反应是化合反应且不是氧化还原反应,二氧化氮和水反应生成硝酸和一氧化氮,属于氧化还原反应,所以反应原理不同,故错误;D项,碳单质直接和氧气反应能生成一氧化碳和二氧化碳,氮气直接和氧气反应只生成一氧化氮,硫和氧气直接反应只生成二氧化硫,故错误。
本题难度:一般
5、填空题 (6分)请用学过的知识分析其中的化学原理并写出化学方程式,属于离子反应的请写出离子方程式。(1)将氯气通入熟石灰即可制的漂白粉【漂白粉的有效成分是次氯酸钙Ca 91exam.org(ClO)2,商品漂白粉往往含有Ca(OH)2等杂质】?。(2)漂白粉之所以具有漂白作用是由于Ca(ClO)2在水溶液中发生水解反应生成具有强氧化性的物质?。(3)Ca(OH)2杂质的存在使溶液的碱性增强,因此漂白作用进行缓慢。要在短时间受到漂白效果,必须除去Ca(OH)2,所以工业上使用漂白粉是常加入少量弱酸如醋酸等,或加入少量的稀盐酸?、
??。(4)家庭使用漂白粉不必加酸,因为水中的CO2也起到了弱酸的作用?。(5)不要将漂白粉与洁厕剂等强酸性物质混合使用,因为在强酸性条件下二者可以发生氧化还原反应生成一种有毒气体:?
参考答案:(每空1分)(1)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O? (2)ClO-+H2O=HClO+OH-
(3)OH-+CH3COOH=CH3COO-+H2O;OH-+H+=H2O? (4)Ca2++2ClO-+H2O+CO2=CaCO3+2HClO
(5)ClO-+2H++Cl-=Cl2↑+H2O
本题解析:略
本题难度:简单