1、选择题 下列叙述中,不正确的是( )
A.氯气能溶解于水
B.氯气是一种有毒气体
C.氯气、液氯和氯水是同一种物质
D.氯气是一种黄绿色、有刺激性气味的气体
E.氯气是一种黄绿色、有刺激性气味的气体
参考答案:A.常温下,1体积水中能溶解2体积氯气,故A正确;
B.氯气是具有强氧化性、腐蚀性的极毒性气体,吸入人体,会出现以急性呼吸系统损害为主的全身性疾病,故B正确;
C.液氯是氯气的液态形式,是单质,而氯水是氯气的水溶液,是混合物,故C错误;
D.氯气在常温下为气态,颜色为黄绿色,有刺激性,故D正确;
故选C.
本题解析:
本题难度:一般
2、选择题 用氯气消毒的自来水配制下列溶液时,会使配得的溶液变质的是
[? ]
①NaOH ②AgNO3 ③Na2CO3 ④NaBr ⑤FeCl2
A.只有②④
B.只有④⑤
C.只有②④⑤
D.全部
参考答案:D
本题解析:
本题难度:简单
3、实验题 某学生对SO2与漂粉精的反应进行实验探究:
操作
| 现象
|
取适量漂粉精固体,加入100mL水
| 部分固体溶解,溶液略有颜色
|
过滤,测漂粉精溶液的pH
| pH试纸先变蓝,后褪色
|
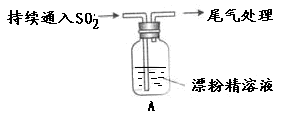
| 液面上方出现白雾;
稍后,出现浑浊,溶液变为黄绿色;
稍后,产生大量白色沉淀,黄绿色褪去
|
?
(1)写出C12和Ca(OH)2制取漂粉精的化学方程式??;?
(2)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a目的是?;
②由实验a、b不能判断白雾中含有HC1,理由是?;
(3)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是?;
②用离子方程式解释现象iii中黄绿色褪去的原因:?。
(4)测定漂粉精有效成分的质量分数。称取2.000 g漂粉精于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.2000 mol·L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:3C1O-+ I- ="=" 3C1-+ IO3-
IO3- + 5I-+ 3H2O ="=" 6OH-+ 3I2
实验测得数据如下表所示。
滴定次数
| 1
| 2
| 3
|
KI溶液体积/mL
| 19.98
| 20.02
| 20.00
|
?
该漂白粉中有效成分的质量分数为?。
参考答案:(1)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
(2)①验证Cl2存在②与硝酸酸化的AgNO3产生的白色沉淀也可能是Ag2SO4或Ag2SO3
(3)①CaSO4?②SO2+Cl2+2H2O=4H++SO42-+2Cl-?(4)42.90%(4分,数据对且符合有效数字要求)
本题解析:(1)Cl2和Ca(OH)2生成氯化钙、次氯酸钙与水;(2)①反应中生成Cl2,用湿润的碘化钾淀粉试纸检验白雾中是否Cl2,排除Cl2干扰;②白雾中含有SO2,可以被硝酸氧化为硫酸,故SO2可以使酸化的AgNO3溶液产生白色沉淀;(3)①A瓶中混合物过滤、洗涤得沉淀X,向X中加入稀HC1,无明显变化,不含CaSO3。取上层清液,加入BaC12溶液,产生白色沉淀,说明有SO42-。故X中含有的物质是CaSO4;②iii中黄绿色褪去的原因是SO2还原了Cl2的原因:SO2+Cl2+2H2O=4H++SO42-+2Cl-;(4)根据反应原理可知3~2KI,平均消耗KI为20.00mL,为20.00×10-3×0.2000mol=4.000mol,即漂白粉含6.000×10-3mol Ca(C1O)2,即0.8580g,故该漂白粉中有效成分的质量分数为42.90%。
本题难度:困难
4、实验题 二氧化锰与浓盐酸混合加热得到氯气,如图是制取并探究Cl2化学性质的装置图。
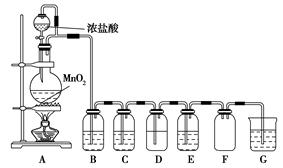
(1)圆底烧瓶中发生反应的化学方程式为?。
(2)若要得到干燥纯净的气体,B、C中应分别盛放的试剂为?、?。
(3)E中若装有FeCl2溶液,反应的离子方程式为?,E中若装有淀粉碘化钾溶液,能观察到的实验现象是?。
(4)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气。针对上述现象某化学兴趣小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通入HCl气体加热
b.稀盐酸滴入MnO2中,然后加入NaCl固体加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸加热
d.MnO2与NaCl的浓溶液混合加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是?,实验c的目的是?。
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此得出影响氯气生成的原因是 ?。
参考答案:(1)MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)饱和食盐水 浓硫酸
(3)2Fe2++Cl2=2Fe3++2Cl-
溶液变蓝
(4)①探究c(Cl-)对反应的影响 探究c(H+)对反应的影响 ②c(H+)的大小
本题解析:(1)MnO2与浓盐酸反应的化学方程式为:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(2)用该方法制得的氯气中含有HCl和水蒸气,分别用饱和食盐水和浓硫酸除去。
(3)氯气与FeCl2溶液反应的离子方程式是:2Fe2++Cl2=2Fe3++2Cl-。氯气将KI氧化为单质碘,单质碘使淀粉变蓝色。
(4)对比a、b、c、d、e五个实验方案可以看出,五个实验中都有MnO2和Cl-,只有a、c、e中有较高浓度的H+,这三个实验产生了Cl2,b、d中有较高浓度的Cl-,但无H+,没有产生Cl2,说明影响氯气生成的原因是H+浓度的大小。实验b的目的是探究c(Cl-)对反应的影响,实验c的目的是探究c(H+)对反应的影响。
本题难度:一般
5、填空题 下列A ~ I九种物质之间的转化关系如图所示;其中部分生成物或反应条件已略去。已知A为固态单质,常温下C、E、F都是无色气体。
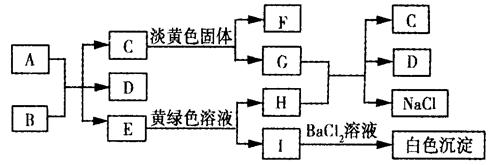
请填空:
(1)C的固体属于_____晶体,F的化学式(分子式)是________。
(2)A与B反应的化学方程式是:?。
(3)G与H反应的离子方程式是?,
E转变为H和I的离子方程式是?。
参考答案: ?(1)分子? O2
?(1)分子? O2
(2)C + 2H2SO4 (浓) ??2SO2 + CO2↑+ 2H2O
(3)CO + 2H+
+ 2H+??CO2↑+ H2O
SO2 + Cl2 + 2H2O ??4H + + SO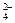 + 2Cl –
+ 2Cl –
本题解析:根据题目提供的转化关系,可知淡黄色固体为Na2O2,黄绿色溶液为氯水。向I溶液中加入BaCl2溶液时,有白色沉淀生成知,I溶液中含有SO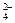 ,而E为气体推知为SO2 : SO2 + Cl2 + 2H2O
,而E为气体推知为SO2 : SO2 + Cl2 + 2H2O ??2HCl + H2SO4,所以H为盐酸(HCl),C为CO2、D为H2O,F为O2,A为C,B为浓H2SO4。
本题难度:一般